多发性硬化(MS)是一种影响中枢神经系统的慢性疾病,该疾病有多个阶段,目前无法治愈。该文章研究了MS的背景、发病机制,以及用于开发针对此自身免疫性疾病的新疗法的常见啮齿动物模型。
什么是多发性硬化?
多发性硬化(MS)是一种炎症性自身免疫性疾病,影响中枢神经系统(CNS),特别是脊髓。由于免疫系统和神经系统都参该疾病的发生,所以导致髓鞘破坏和神经损伤。因此引发了各种各样的运动症状和非运动症状,这些症状在患者中各不相同,包括疲劳、痉挛、行走困难、视力问题、言语、膀胱和肠功能障碍、疼痛、认知和情绪变化以及抑郁症。
多种因素导致MS
虽然MS的病因尚不清楚,但它被认为是具有多因素起源的异质性疾病。人们普遍认为MS是多种遗传、感染和环境因素相互作用的结果,也是免疫介导的反应。通过单卵双胎的研究说明,它们可能会产生不同程度的疾病。
大量研究显示,影响MS的几个主要因素包括:
- 紫外线辐射
- 维生素D
- 吸烟
- 肥胖
此外,感染也可能引发MS,特别是EB病毒感染,已被确定为危险因素。
最近的研究还发现,微生物可以影响啮齿动物模型的MS结果。观察发现,微生物既具有疾病诱导也具有对CNS自身免疫的疾病保护影响。
多发性硬化的临床阶段
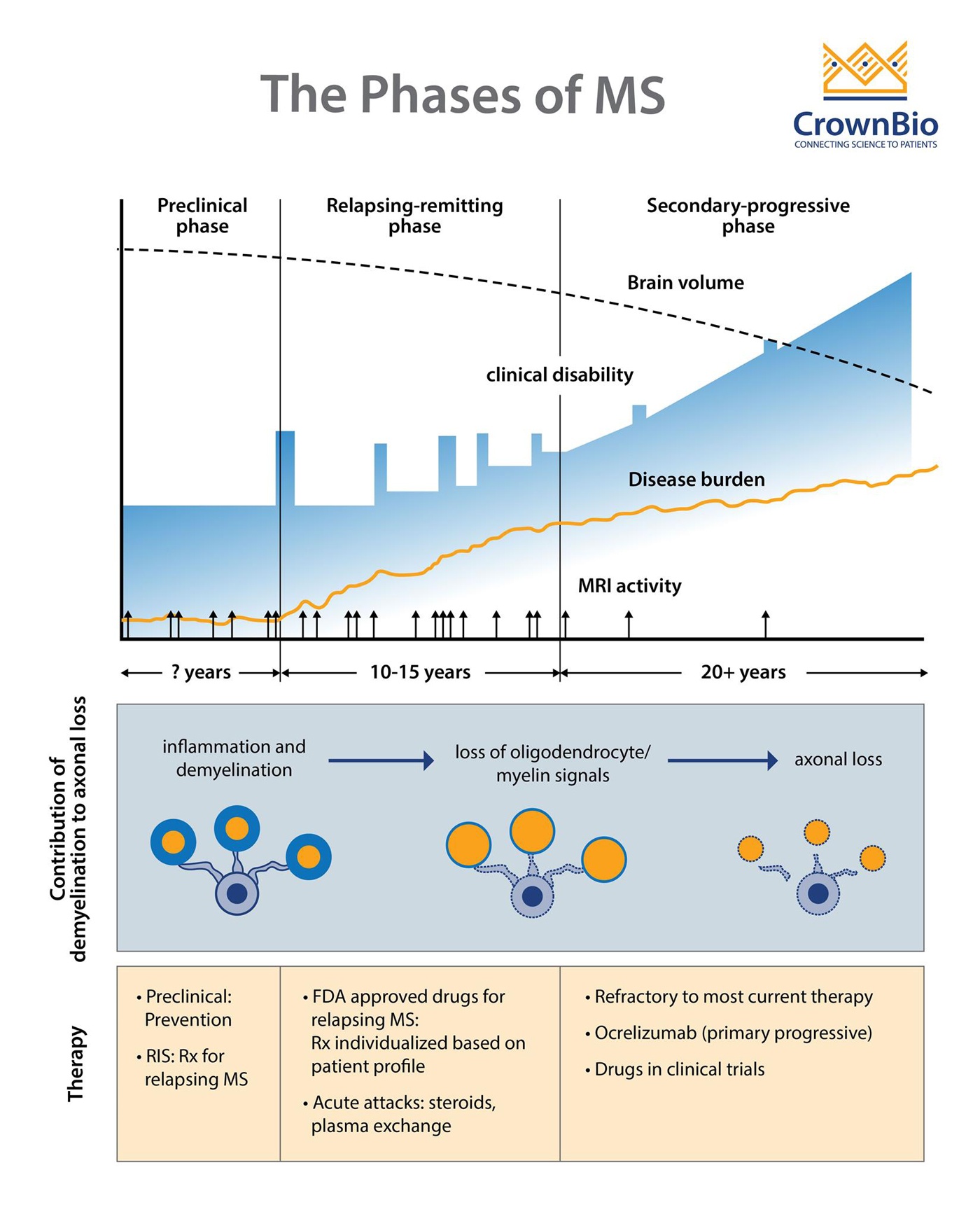
Adapted from Multiple Sclerosis, Disease Management website, Cleveland Clinic, Chandran et al. Phiilos Trans R Soc Lond B Biol Sci 2008;363(1489): 171-83, and Baecher-Allan et al. Neuron 2018;97(4):742-68.
MS包括三个临床阶段:
- 通过核磁共振(MRI)检测到的临床前阶段。
- 复发阶段(RRMS),特征为神经功能障碍(视神经炎、感觉和运动障碍),然后是持续数月或数年的部分或完全障碍。
- 进行性阶段,通常从复发阶段发展为运动功能逐渐恶化。
在一些患者中,MS可以从发作逐渐进展为原发性进行性疾病(PPMS)。 目前尚不清楚PPMS是否为MS的独特形式,或者是否为继发性进展性MS(SPMS),其中复发在临床上并不明显。 大约60-70%的PPMS患者变为SPMS。
MS的疾病机制
MS的病因尚不清楚,目前认为主要原因是针对CNS抗原的异常免疫反应。在外周耐受性丧失后,自身反应性T细胞(CD8 +、Th1和Th17细胞)、B细胞、树突细胞和巨噬细胞穿过血脑屏障并渗透脑脊液屏障渗入脑中。
最近的实验表明Th17细胞通过诱导内皮细胞内的活性氧,对血脑屏障的破坏起重要作用。血脑屏障的破坏进一步增加了免疫细胞CNS浸润和血管周血脑脊液屏障免疫细胞的积聚。
早期MS的特征
在疾病早期阶段,免疫细胞、活化的CNS小胶质细胞和星形胶质细胞促进少突胶质细胞和轴突变性。促进各种机制来抵消神经组织损伤。
活动性病变在RRMS中很常见(但在进行性MS中很少见),涉及白质和灰质。实际上,皮层和深层灰质萎缩是MS神经功能障碍的最佳预测因素,与疾病进展有关。
后期MS的特点
在疾病晚期,组织修复能力丧失。免疫细胞浸润下降,但CNS介导的炎症依然存在。在MS的进行期中,髓下病灶相对丰富,并且小胶质细胞活化比外周免疫细胞浸润更重要。
巨噬细胞和小胶质细胞都聚集在在MS活跃的脱髓鞘和神经变性部位。这种负面环境与其他因素一起抑制少突胶质细胞的增殖和分化,并进一步促进神经变性过程。
复发和进行性MS机制
复发性MS主要由渗入CNS的免疫细胞引起。 因此,增加调节细胞功能或减少效应细胞数量、功能从而阻止细胞向CNS转移的治疗在复发MS中显示出惊人功效。
进行性MS包括免疫依赖性和非免疫依赖性机制。免疫依赖性机制是由小胶质细胞、巨噬细胞和B细胞介导的脑内先天性免疫反应以及脑膜中的淋巴样毛囊所引起的。非免疫依赖性机制包括线粒体损伤,氧化应激和离子失衡。
目前没有针对MS的有效疗法,有必要采取新的疗法治疗该疾病。其中,恢复细胞损伤和脱髓鞘的疗法非常。
MS的小鼠模型
由于MS的复杂性和异质性,因此在啮齿动物模型中再现该疾病是困难的。研究人员根据工作所需的临床严重程度可以有多种选择。
脑脊髓炎模型
自身免疫性脑脊髓炎(EAE)模型是最古老、最常用的人类MS实验模型。
EAE包括了MS中观察到的病理特征,包括:
- 炎症
- 脱髓鞘
- 轴突丧失
- 神经胶质过多症
该模型还可以研究炎症和髓鞘再生的解决反调节机制。但是,MS的每个方面都需要在EAE模型中进行单独研究,增加了数据分析的难度。
此外,研究中使用的不同试剂可能会导致不同程度的疾病。
在小鼠中,使用不同浓度的百日咳毒素进行实验性血液屏障损伤后,通过主动免疫诱导EAE。通过使用含有能够激活先天免疫系统的细菌成分的佐剂实现对髓磷脂抗原的敏感作用。由于人类中的活化抗原尚不清楚,因此使用多种CNS组织抗原如髓鞘碱性蛋白(MBP)、蛋白脂质蛋白(PLP139-151)或髓磷脂少突胶质细胞糖蛋白肽35-55(MOG35-55)诱导产生EAE。
易感动物染色发病率高,发病时间为9-12天后,随后出现各种病理和临床症状。MOG35-55模型诱导了单相、持续形式的EAE,而PLP139-151和MBP模型的特征是EAE的多个阶段,这使人联想到RRMS。
过继转移EAE模型
另一种模型是过继转移EAE。通过主动免疫在供体动物中产生的髓磷脂特异性CD4T细胞被注射到受体免疫缺陷动物中。研究人员发现,在EAE研究中观察到的许多发现都得到了MS的证实。
MS Cuprizone小鼠模型
最后,Cuprizone小鼠模型绕过了EAE模型的自身免疫成分,提供了研究脱髓鞘和胶质增生,或胶质细胞亚型快速增殖的替代方法。 Cuprizone是一种铜螯合剂,可口服给药,因此是最常用的毒物诱导MS模型。
MS尚未解决的问题
各种研究领域(尤其是涉及MS的神经免疫机制的研究)的进展推动了靶向效应T细胞、调节性细胞、B细胞和细胞转运到CNS中的药物的研发。大多数药物在RRMS中有效。然而,没有一种对进行性疾病有效。
导致这种差异的可能是由于目前尚未完全了解该疾病的生物学机制的差异。 例如,在2017年3月被FDA批准用于PPMS 的ocrelizumab(一种B细胞消耗抗CD20单克隆抗体),揭示了B细胞在MS中的作用机制。由Baker等人发表的许多药物被FDA批准用于治疗MS消耗记忆B细胞。目前,FDA已批准100多种药物用于MS,这些药物主要针对免疫细胞。
MS药物研发重点
鉴于MS的复杂性和异质性,对患者进行分组、时刻了解疾病进展和疗效的生物标志物可以极大地改善临床试验。
个性化医疗和成像技术的进步,以及对微生物组的更好理解,也将有助于实现这一目标,并改善疾病的生理病理学。