尽管临床前2D体外模型的测试结果令人满意,但依然有高达95%的抗癌新药最终在临床试验中失败。在体内能够更好地模拟肿瘤生物学的新模型可以有效促进药物的研究进展。
本文着眼于先进的3D体外模型,包括肿瘤球体和类器官。
为什么2D体外模型不容易转移?
目前,药物主要通过细胞培养进行研发,这提高了临床前肿瘤学研究的速度和效率。在平皿上培养细胞可以培育2D单层。当细胞在表面扩散时,细胞受到额外的压力,并且它们不参与有效的细胞间相互作用及细胞与基质相互作用。
这些因素会影响基因表达和蛋白质功能。此外,肿瘤细胞系的传代数越高,遗传畸变越大。另外,对培养条件高度敏感的阳性克隆选择导致了细胞系异质性。
由此产生了一个问题,即 2D细胞培养模型是否能够代表相应的原位肿瘤?如果无法代表相应的原位肿瘤,是否导致体内转化不良?
是否有更好的体外实验方法促进肿瘤药物的研发?
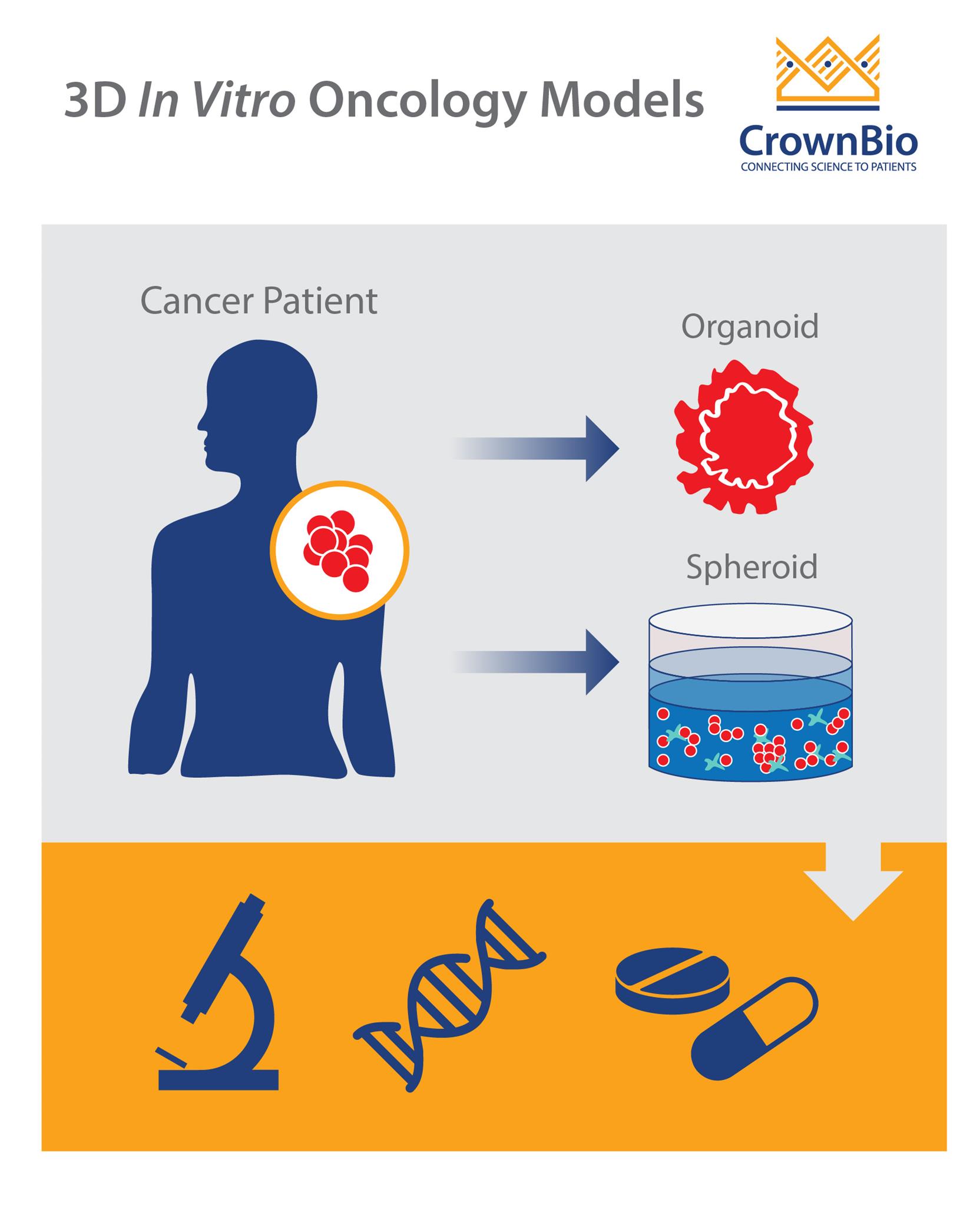
更有效的3D体外模型
最近推出的3D细胞培养,能更好地模拟体内异质性、天然组织结构以及对治疗的响应。
“3D细胞培养”包括肿瘤球状体和3D结构,这两种技术之间存在显着差异。
肿瘤球状体
肿瘤球状体是肿瘤细胞的球形聚集体,他们可自组织和自我更新。它们可能来源于肿瘤细胞系、患者衍生的肿瘤细胞或肿瘤干细胞的单细胞悬浮液。
充分利用肿瘤球体的检测方法是3D肿瘤生长检测(3D TGA),这是一个成熟的肿瘤药物开发平台。3D TGA提供的培养条件比2D培养更接近人类状况。
在该测定中,肿瘤细胞被嵌入到一个低硬度、富含层粘连蛋白的细胞外基质中。人类间质干细胞和患者来源的肿瘤相关成纤维细胞也可包括在共培养物中。这样的培养方式提供了存在于实体瘤的肿瘤微环境(TME)中的旁分泌信号。
3D TGA添加了激素(例如DHT / E2),葡萄糖限制在≤7mM,维持的pH为6.8。 提供了“人源化”的3D分析方法,用于分析PDX衍生细胞和药物。
研究表明,在3D TGA中对抗癌药物的反应与体内药效以及预期的临床结果之间存在相关性。
肿瘤类器官
类器官是在试管中培养的小型3D版本的器官。特别是肿瘤器官,是通过新鲜组织检查获得的原发性肿瘤组织的三维模型。
类器官可从干细胞或原代组织(收瘤或活组织检查)产生。干细胞可以是胚胎干细胞(ESCs),也可以是诱导多能干细胞(iPSC),其自我更新和分化特性得以产生几乎包含任何细胞类型的类器官。
通过将原始肿瘤切片或酶消化成小块来产生类器官。然后与3D球体测定类似,将细胞包埋在基底膜基质中,例如Matrigel TM或其他胶原,其中含有信号化学物质的混合物以驱动形成所需的类器官。
或者,干细胞可以分化成特定的细胞类型,然后在成熟后植入一个特定的3D环境中。
什么是类器官?
根据Lancaster和Knoblich的判断,需要满足以下:/p>
- 多器官特定细胞类型:类器官必须包含不止一种细胞类型的器官
- 类器官必须能够表现出某些特定器官的功能(如代谢、神经活动、收缩)
- 细胞应与器官类似
类器官代表着越来越多的不同器官。如今已有:肺、胃、胰腺、大脑、眼睛、肝脏、皮肤等更多肿瘤组织。
大量的出版物表明,类器官再现了肿瘤的异质性——保留了原发性肿瘤的分子特征,包括基因组和转录的改变。
Sachs等人最近的一项研究从155个肿瘤中提取了95个乳腺癌类器官。基因表达分析显示,类器官表现出乳腺癌亚型的代表性基因表达谱。还保留了类器官形态,并与原始肿瘤的组织病理学,激素受体和HER2状态相匹配。
该研究表明类器官肿瘤模型可用于药物研发和转化医学。
器官芯片
在体外研究中的一个热门话题是在芯片上模拟人体器官,用物理和化学的方法,用微流体设备技术模拟体外环境。
除了模仿组织或器官的3D结构外,器官芯片可以更准确地反映出生理条件和结构微环境,在体外试验中提供更多的预测。
多种器官和组织,如肺、肝、肾、肠等,已被复制为体外模型,并广泛应用于肿瘤芯片技术。
总结
3D体外模型,如肿瘤球状体和类器官,为肿瘤研究、免疫治疗研究和药物筛选提供了新的研究方法。