探讨临床前小鼠肿瘤模型的代谢来研究循环肿瘤细胞(CTCs)和用于分离和表征CTCs的技术
临床前小鼠转移模型
我们已经报导过哪些临床小鼠模型可以完美模拟人类转移性癌的过程。在这篇文章中,我们将专注于使用这些模型来研究循环肿瘤细胞,包括最新的分离和描述CTCs的技术。在分子和功能水平上分离和表征CTCs对肿瘤学的治疗发展有很大的前景。
建立体内肿瘤细胞循环模型
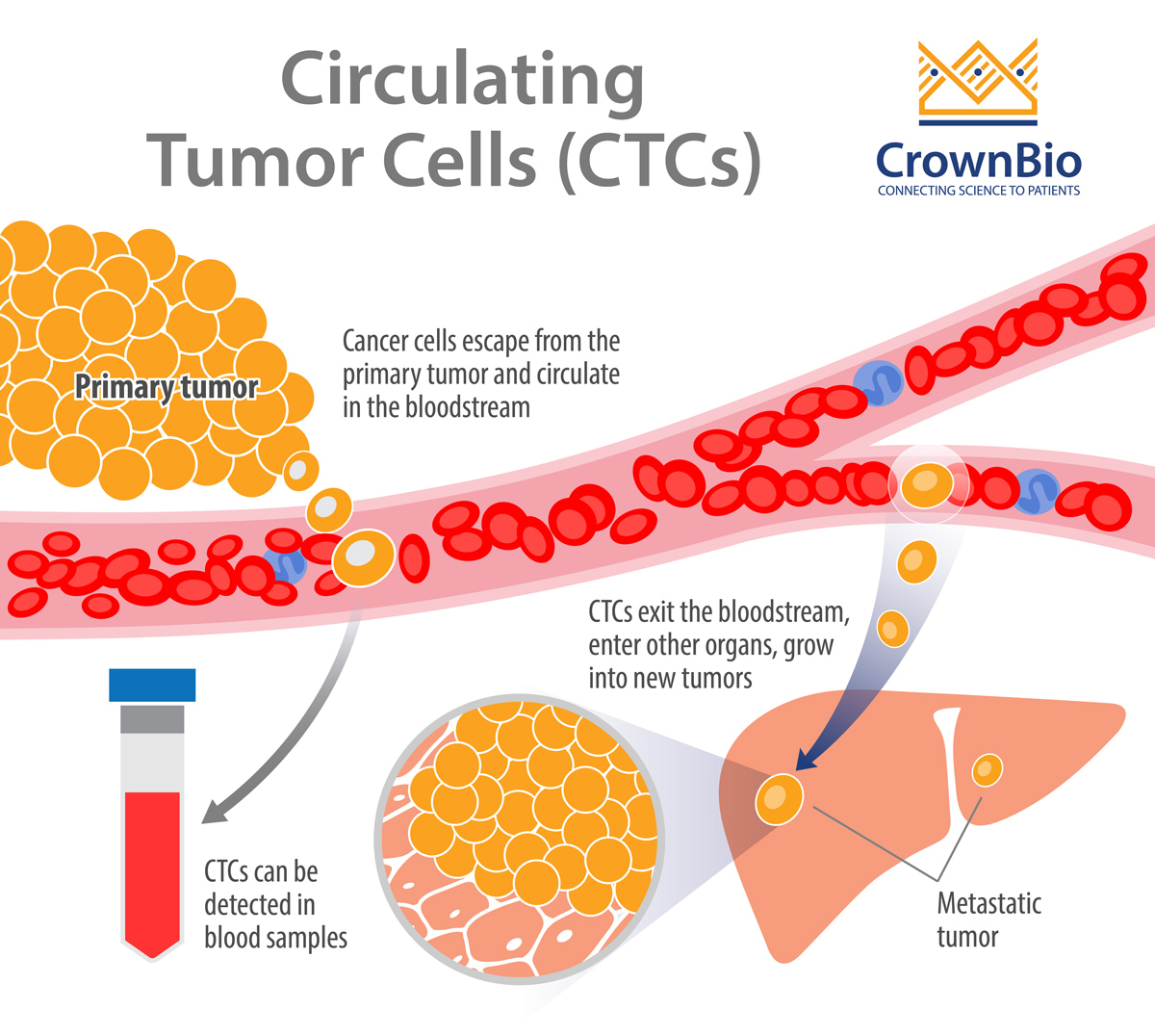
从根本上讲,CTCs是从肿瘤原发或转移位点脱落的癌细胞,它们以单细胞或聚集体的形式通过血液和/或淋巴管循环。一部分CTCs存活下来,渗入空隙,最后在新的远端的微环境内形成肿瘤。
“液体活检”是指检测,表征和监测从外周血内分离出的非血液学癌症的CTCs细胞。液体活检吸引了众多相关人员的关注,其中包括药物开发人员和临床医生。这是因为CTCs可以用作药物靶标,指导癌症治疗(例如评估疗效,根据分子特征调整治疗,监测残留疾病)并减轻传统组织活检相关的负担。
临床前CTCs模型
为了在临床前小鼠模型中研究CTC,必须在体内产生转移性疾病。有许多转移模型可用,每种模型在完美模拟人类转移性癌的过程中都各有利弊。
一旦理想的转移模型被选择了,CTC分析将为开发新的生物标志物以及表征和追踪转移性疾病的进展提供独特的机会,这可以为新型临床治疗提供关键见解。由于这些原因,临床前转移模型越来越多地被用于研究CTC,并且也可使用从患者血液样本中分离或体外扩增后的CTC直接建立转移模型。
乳腺癌
患者来源的异质瘤肿瘤模型(PDX)中检测出CTCs。这类模型可以提供稳定且再生的CTCs,从而可以研究CTCs和潜在的转移过程。
乳腺癌CTCs细胞系已经建立,并用于鉴定脑转移的潜在特征。当将异种移植到免疫缺陷小鼠体内时,具有这种特征的CTCs被发现具有高度侵袭性,并产生脑转移和肺转移。同样,从具有雌激素受体阳性的乳腺癌的患者中分离并建立的乳腺癌CTCs细胞系,60%在小鼠中具有致瘤性。
肺癌
患者来源的CTCs被用于建立CTC来源的外植体临床前小鼠模型,其中包括具有高表达CTC的小细胞肺癌(SCLC)。例如,患者来源的SCLC CTC在免疫缺陷小鼠中具有致瘤性,而且CTC来源的模型还能反映供体患者对化学疗法的反应。
结肠癌
一个来自结肠癌患者的CTC的稳定细胞系被建立了,它们具有原始肿瘤的特征,并在免疫缺陷的动物中诱发肿瘤,从而可以进行功能研究和药物评估。
富集和表征CTCs
在进行CTC研究之前,研究人员应通过富集和表征CTC技术来熟悉他们。尤其是,由于CTC的以下特性,富集仍是主要的技术挑战
- 外周血少见(估计每105-108个白细胞约产生1 个CTC)。
- 疑似半衰期短
- 缺乏可靠的表面生物标志物。
但是,近来的技术进步帮助克服了一些挑战,并且存在可收集和识别CTC的商用平台。
CTCs通常被认定为表达上皮标记细胞角蛋白(CK)/ EpCAM但不表达CD45的有核细胞。 但是,当前通过识别上皮特异性标记物捕获CTC技术的缺点是没法检测经上皮-间质转化(EMT)后且不再过表达EpCAM的CTC。经过EMT的CTC会获得间质形态,这与显著表达间质标记物(例如:波形蛋白(CSV),Slug或Twist)有关,可以用作识别更广泛表型的替代或补充方法。
CTC获取
免疫磁珠富集CTCs是最常用的捕获CTCs的技术。它依赖于磁珠的分离技术,使用与磁珠偶联的抗体从血样中富集CTCs。抗体通过靶向上皮或肿瘤特异性抗原来结合CTCs,或者通过靶向血细胞抗原(例如CD45)来排除CTC。
许多商业供应商销售不同的产品。 值得注意的是,某些阳性结合产品(例如:基于EpCAM的系统)仅靶向上皮细胞。 如今,CellSearch®CTC Kit是唯一获得FDA批准的检测全血中上皮来源CTC(CD45-,EpCAM +和细胞角蛋白8、18+和/或19+)的产品。
密度富集依赖于CTCs的密度通常低于血细胞的密度。有几家商业供应商通过密度将CTC与血细胞分开。该技术可捕获上皮和间充质CTC,通常易于使用且价格便宜,但是该方法的特异性比较低。
基于大小的富集依赖于CTC和白细胞之间大小的差异。 CTC比白细胞大,不同的过滤孔径可将两者分开。 技术可捕获上皮和间质CTC,并且通常也易于使用且价格便宜。但是,较小尺寸的CTCs可能会丢失。
微流体的富集是使全血通过含有芯片的微通道。当CTCs过通道时,它们会被附着在“微柱”上的抗体捕获或按大小过滤。多种微流体选项是可商购的。这些设备可以处理的液体量在微升到纳升的范围内,并且它们通常可以高浓度富集和分离完整的CTC。
CTC特征
不论富集技术如何,都需要后续下游的表征(即检测,计数和/或分子表征),这可以使用多种基于蛋白质和/或核酸的方法来实现。
基于蛋白质的检测和分子表征是通过一种或多种技术进行的。常见的包括流式细胞术和免疫荧光,它们依赖于靶向CTC上抗原的荧光偶联抗体。然后使用特定激光或图像来进行识别 基于核酸的检测和分子表征通常是通过实时定量PCR进行的,PCR可基于特定基因的表达来识别CTC。其他技术已经越来越多的被使用了,例如下一代测序和其他基因组分析。值得注意的是,这些分析方法无法准确定量CTCs或回收CTCs用于其他分析。
除了CTCs外,液体活检还提供了评估ctDNA的机会。这是另一种具有高敏感性的循环生物标志物,可用于治疗选择,反应监测以及监测肿瘤负荷和疾病的分子特征。 ctDNA的分离和分析在技术上可能要求较低,每种生物标记物都有各自的优缺点。因此,研究人员应仔细考虑选择生物标志物,从而实现其特定的研究目标。
结论
临床前转移小鼠模型对于CTC的研究具有不可估量的价值,并且越来越多地被用于研究实验。 一旦选择了合适的转移模型,就可以利用CTC分析来开发新的生物标记物,并表征和跟踪转移性疾病的发展过程。
此外,对于CTC的分离和表征,研究人员有多种选择可以考虑。在开始CTC研究之前,研究人员应了解每种选择的优缺点。