回顾HUB类器官的开发和使用,从Clevers实验室首次发现Lgr5,到导致如今广泛使用的模型特征和数据。
类器官的历史
自20世纪70年代后期以来,研究人员一直试图建立健康人体细胞的长期体外培养物,以研究人体发育和形态发生。在Knoblich和Sasai的开创性著作之后,“类器官”一词变得越来越流行。目前,它用于表示源自成体、胚胎或诱导性多能干细胞的3D细胞模型,这些模型在体外得以维持,并产生微型器官。
类器官是唯一能忠实体现原组织生理学的体外技术,可为药物开发和组织工程等应用提供快速且经济高效的模型。
成体干细胞鉴别
人们一直普遍认为,受损后器官再生必需要有具有自我更新和分化特性的细胞池。然而,由于缺乏干细胞特异性生物标志物,成体干细胞(aSCs)的鉴别长期以来难以实现。
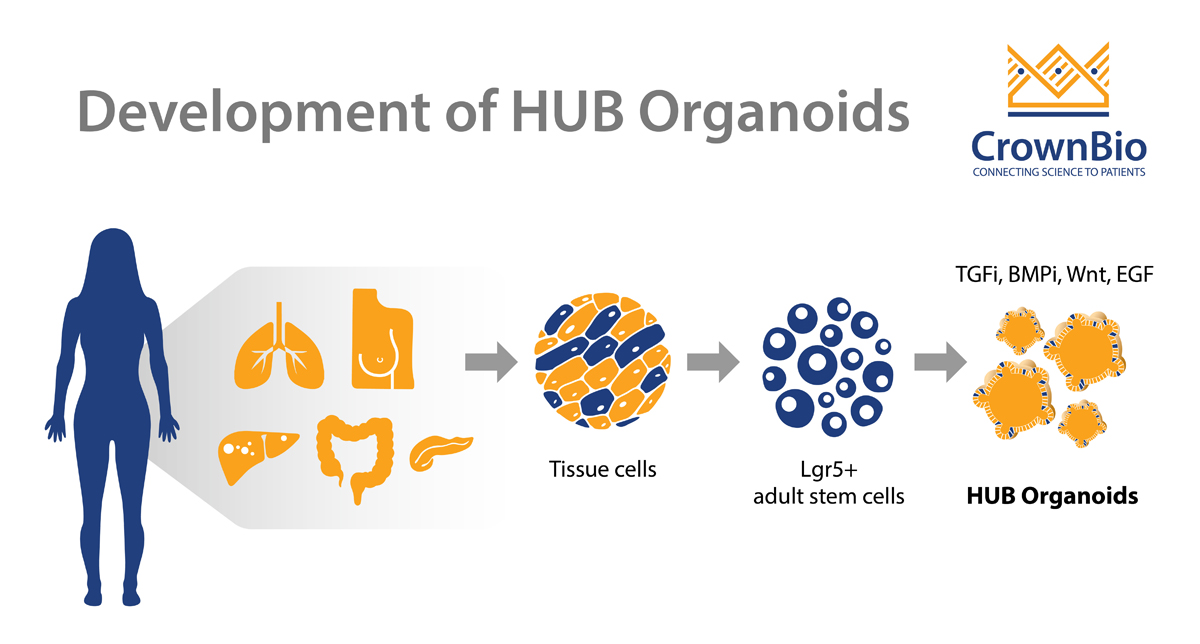
随着Clevers实验室发现Lgr5作为小肠的成体干细胞生物标志物,突破随之而来。这一发现是Hubrecht Organoid Technology(HUB)掌握的新技术开发和aSC来源的类器官大规模生产的踏脚石。
该开创性论文发表使用基因敲入小鼠模型结合对肠道内稳态和癌症调节的深入了解,将Lgr5+细胞鉴别为小肠和结肠的干细胞。进一步的研究表明,Lgr5是上皮起源的多个器官(例如胃、肝和胰腺)中的干细胞标记物。
类器官发展
鉴别肠道aSC后,Clevers实验室从单个Lgr5+干细胞开始建立了体外肠道类器官培养物。每个干细胞均于独立环境培养运作,以生成自组织的上皮结构,该结构类似于正常肠道,可以连续扩增,并且可以长期培养。这些扩增的隐窝细胞经历多次隐窝裂变事件,生成包含分化细胞类型的绒毛样上皮域。aSC来源的类器官遗传型和表型均非常稳定,并且可以传代很多年。
为了证明在培养时的稳定性,从单个Lgr5结肠干细胞中生长出大量类器官,并将其原位移植到肠道损伤的结肠炎模型中。类器官易于整合为功能性肠上皮斑块,与周围正常上皮没有区别。
原类器官方法适用于从许多不同器官生成类器官。使用此技术来生长微型器官所需的组分相当保守,包括:
- Wnt的强大来源,因为Wnt通路已成为维持干细胞命运和驱动干细胞增殖的关键因素
- 酪氨酸蛋白激酶受体信号传导的有效激活剂,例如EGF,对干细胞产生促有丝分裂作用
- 抑制通常会促进分化的BMP/Tgfb信号
- 基质胶模拟细胞外环境
初生组织的小片段也可用作类器官发育的起始材料。这可能是因为组织裂解和在调节的培养基中培养可以模拟体内损伤反应的环境。这可以使已分化的细胞恢复为干细胞状态。
开发人体组织的生物样本活库
一旦建立了“正常”组织类器官的方案,HUB和其他研究中心的科学家就对该技术进行了改进,从原发性人 结肠、前列腺和胰腺 癌中生长类器官。
HUB研究人员首次报告了大型结直肠癌(CRC)肿瘤类器官库的生成,该库被定义为患者来源类器官(PDO)的“生物样本活库”。PDO为功能性药物测试提供了独特机遇,例如敏感性筛选以及将治疗数据与单个肿瘤的遗传组成相关联。
HUB肿瘤类器官:稳健且可重现的体外模型
如今,HUB研究人员已经优化了从健康和患病组织中获取和维持3D离体类器官的方案,并由多个器官开发了大型PDO生物样本活库。HUB类器官已成为肿瘤药物开发的稳健临床前平台,Clevers实验室/HUB方案被其他研究小组广泛使用和发表。这是由于HUB类器官的许多功能和应用导致。例如,类器官稳定性是HUB研究人员用来开发大规模药物筛选之等应用的关键方面。
HUB肿瘤类器官还密切体现了原肿瘤的多种特性,例如基因扩增、体细胞拷贝数和突变。每个类器官代表其亲代患者肿瘤,并保持遗传和表型特征。从连续20例结直肠癌患者中建立的肿瘤类器官 显示出其密切模仿了原肿瘤的多种特性。
CRC类器官的生物样本活库中的遗传信息也完整无缺。该遗传信息与之前CRC的大规模突变分析相符,表明肿瘤类器官代表了CRC主要分子亚型。这些特征意味着HUB类器官对于进行高通量药物筛选以研究基因药物关联并补充细胞系和异种移植研究是理想选择。
来自转移性结直肠癌患者的HUB类器官生物样本活库的表型和遗传图谱显示出与原患者肿瘤的相似度。在药物筛选中使用这些类器官表明,对一种药剂的反应或无反应与类器官分子特征有关。
其他研究也在临床试验中比较了离体类器官、基于PDO的原位小鼠异种移植肿瘤模型和癌症患者的反应。这些数据表明,PDO在临床上忠实地体现了患者反应,并有潜力用作药物筛选平台。
结论
HUB方案为类器官的开发提供了坚实基础,为模型开发提供了强大的科学背景。通过建立类器官,科学家可以替换2D常规的、同质性细胞培养物,并将该平台用作更昂贵、更耗时的动物研究的垫脚石。HUB肿瘤类器官已成为预测患者临床转归的可靠临床前模型,为药物开发计划提供了更强的肿瘤学模型选择。