在本篇博文中,我们探讨了药物疗效研究如何通过利用高内涵筛选(HCS)、高内涵成像(HCI)和高内涵分析(HCA)纳入高度全面的形态学读数,从而超越细胞活力评估。
为何在药物疗效筛选研究中使用高内涵筛选?
多数高通量药物筛选采用2D细胞系进行,如OmniScreen,这对于提供快速结果以告知早期决策很有价值。此外,3D体外模型,如肿瘤类器官,越来越多地被用于优化Hubrecht类器官技术(HUB)方案,该方案已建立,以从肿瘤组织开发这些3D模型。大量多样的具有充分定性的类器官收集库(“生物库”),现已捕获在大规模人群研究中观察到的患者人群多样性。
在从这些生物库中鉴别应答者和非应答者的肿瘤模型方面,疗效筛选发挥着重要作用。虽然传统的疗效指标,如细胞滴度Glo®(CTG)发光读数定义的细胞活力的半抑制浓度(IC50),但高内涵服务(HCS、HCI、HCA)现在更常用于在2D和3D模型中生成高度全面的形态学读数。由此产生的高质量和多因素数据可操作,并可用于下游决策,如确定应进一步研究哪些抗癌药物。
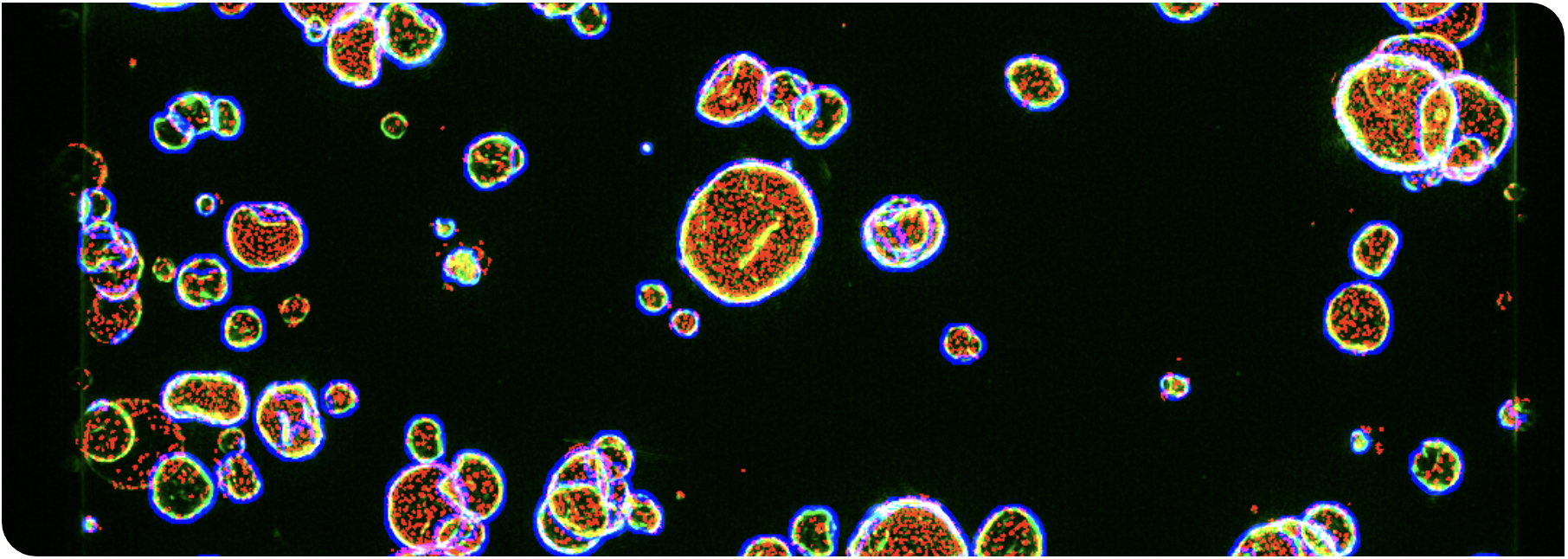
图1显示了CTG与存活细胞核计数的比较情况。将不同的乳腺癌、结肠癌和胰腺癌类器官模型接种在两个平行的384孔3D水凝胶板中,然后暴露于9点化合物剂量范围内5天。对一个平板进行处理,用于CellTiterGlo活力测定。固定平行板,用Hoechst和Phalloidin罗丹明染色,成像,并通过自动3D显微镜收集3D图像堆栈。对细胞核进行了评分和标记,F-肌动蛋白(一种活力指标)呈阳性。
总体而言,观察到的CTG数据与存活细胞核总数的评分非常吻合,表明HCl可以在细胞活力读数方面产生与CTG类似的结果。
然而,如下一节所述,可以通过HCI形态学分析同时评估许多额外的分子参数/特征数据,包括但不限于细胞周期状态、细胞和核的大小与形态、受体内化、蛋白聚集、上皮形成和厚度、细胞极性,以便更好地告知下游的Go/No-go决策。
图1:CTG和HCI计算的IC50值比较。TRITC阳性物(类器官)中存活的DAPI阳性物(核)总数与CellTiterGlo信号密切相关。
超越细胞活力:图像介导的表型分析
在以下示例中,图2比较了正常结肠类器官与结直肠癌(CRC)类器官。化疗氟尿嘧啶(5-FU)治疗后,大肠癌类器官体积缩小(左上图),但同一患者的正常结肠类器官在治疗后继续存活。
然而,额外的形态学分析显示,当健康的结肠类器官暴露于5-FU时,上皮层的厚度(右上图)受到影响:上皮变薄(下图:肌动蛋白为红色,DAPI为蓝色)。这与5-FU通常引起的胃肠道相关不良反应一致。
图2:基于形态学的成像可以提供以下信息:对肿瘤生长的影响,削弱或破坏而不杀伤的影响(毒性窗口),以及对正常细胞的影响。
HCA和表型分析也可用于根据作用机制区分和分类不同的化合物。这是因为当化合物破坏不同的信号通路时,对形态有不同的影响。该策略用于区分双特异性抗体对不同生长因子受体的抑制,从而鉴别出针对EGFR和干细胞标记物LGR5(Herpers 2022)的双特异性抗体(称为MCLA-158)。该抗体现已进入人体临床试验阶段。
正如传统的筛选研究,在用多种浓度的化合物处理细胞后,使用图像介导的形态分析来评估药物反应。然而,基于图像的“Fast Screen”读数,并非使用CTG等细胞活力测定法获得。该类型输出运用了自动化技术的进步帮助其高效输出,能够提供超越细胞活力的高度全面的表型读数。
现代的“Fast Screen”是在一个平板上进行的表型筛选,依靠分析来挑选变化最明显的样本。对图像进行快速分析,并测量所有捕获通道中图像的原始强度(分别用于染色细胞核和肌动蛋白的标准DAPI和TRITC)。虽然快速分析在无需全图像分析的情况下,足以评估化合物治疗的杀灭效果,但如果需要,可以进行全分析,以使分析高度深入,但该分析采用CTG无法实现。
此外,由于快速分析无需图像分析或生物信息学团队花费大量时间,因此总测定成本比全图像分析低25%。该方法可以快速推进实验,因为数据全面,并且经常会阻止额外的中间/后续研究。
图3:基于代表性“快速”图像的活力分析示例。(左)对细胞核和肌动蛋白的快速分析,(右)全z-stack分析在一次检测中产生300多种形态特征。
如前一篇文章所述,HCI平台能够以可扩展的384孔格式对治疗反应进行表型评估,并同时测试单一或多种药物组合策略。利用先进的3D图像分析软件,可以捕获和考虑500多种表型变化(例如肿瘤和细胞核计数、大小、体积、形状;上皮形成和厚度;坏死/凋亡标记;极性;肿胀),以通知下游Go/No-go决策。
自动化高内涵筛选平台和分析
高内涵筛选(HCS)的目的类似于其他传统的高通量筛选(HTS)方法,该方法旨在筛选数亿至数百万种化合物,目的是鉴别新的药物靶点和命中率,或在复杂的细胞系统中进行靶点和先导物优化。
与基于读板仪的传统HTS相比,HCS被认为更具可预测性,因为HCS筛选中使用的HCI可以监测多个与在靶和/或脱靶效应相关的高度详细的表型终点。如上所述,自动化工艺的进步极大地提高了HCI效率和周转时间,使大量筛选能够高效执行。
疗效量化筛选输出示例如下所示。疗效可通过患者和化合物进行量化,并使用标准IC50测定设计预测体内反应,该设计可用于鉴别应答者/非应答者和预测性生物标志物。
图4:疗效量化筛选数据。筛选包括星形孢菌素阳性对照、Z′因子和明视野显微镜检查。
结论
基于图像的高通量技术(如HCS)有助于我们超越细胞活力评估来量化药物疗效。这些评估更能预测体内效应,并有助于做出更明智的下游决策,例如选择最合适的癌症适应症,指导哪些药物向前发展,以及确定最佳组合方案。这些测定帮助我们提高在合适时间开发和交付成功抗癌药物的几率。