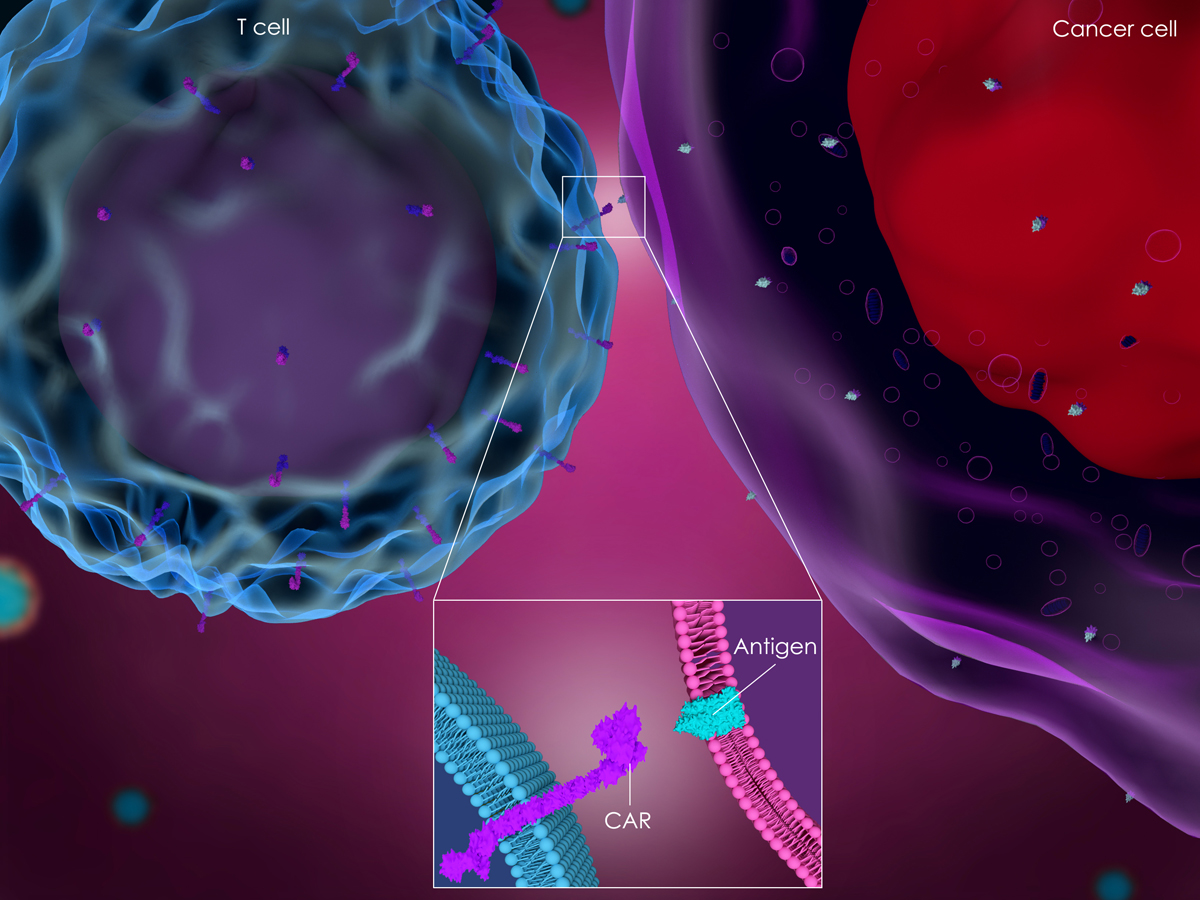
探讨CAR-T细胞治疗如何成为胰腺癌的一种新的治疗手段。
有限的胰腺癌的治疗方法
胰腺癌可选择的治疗方法非常有限。它对许多常见的癌症治疗方法,如化疗、放疗以及靶向药物和免疫疗法(如检查点抑制)都没有反应。胰腺癌的生存率30年来一直没有得到改善,吉西他滨(20年前被批准用于治疗胰腺癌)目前仍然是治疗胰腺癌的标准用药。
为了提高存活率,我们需要寻找新的治疗方案。CAR-T细胞疗法可能成为新型的治疗胰腺癌的方法。
CAR-T治疗胰腺癌
Jiang等报道了CAR-T细胞靶向间叶素(MSLN, mesothelin)疗法治疗胰腺癌的临床前评价结果。MSLN是一种膜蛋白,在胰腺癌以及其他多种癌症中都过量表达。MSLN在正常的腹膜、胸膜和心包间皮表面的表达水平较低,因此是一个非常值得研究的肿瘤靶点。
CAR-T细胞靶向MSLN疗法在间皮瘤和卵巢癌模型中显示出抗肿瘤活性,但本文首次详细介绍本治疗方法应用于治疗胰腺癌模型。
MSLN靶向CAR-T细胞的合成
用慢病毒载体构建一个多靶点的CARs,由人源MSLN-特异性scFv和CD28 / CD3ζCD137 / CD3ζ,或CD28 / CD137 CD3ζ信号域(MSLN-28Z、MSLN-BBZ和MSLN-28BBZ)构成。
然后用编码CAR基因的慢病毒载体转染T细胞,得到MSLN特异性CAR-T细胞用于后续检测。
体外细胞毒性试验
首先,测试这些CAR-T细胞识别和杀死MSLN阳性胰腺癌细胞的能力。这些细胞毒性试验是通过与表达或不表达MSLN的PANC-1细胞一起进行孵育来检测的。
实验结果显示,表达MSLN-28Z、MSLN-BBZ、MSLN-28BBZ的T细胞均能有效地裂解MSLN阳性胰腺癌细胞。而MSLN阴性的PANC-1细胞几乎不能裂解任何MSLN阳性胰腺癌细胞,并且mock T细胞也不能裂解任何靶细胞,这表明CAR-T细胞的靶点依赖特性。
利用人源的异种移植模型进行体内疗效试验
表达MSLN-28Z和MSLN-28BBZ的T细胞与表达MSLN-BBZ 的T细胞相比,前者能更有效的裂解肿瘤并可以刺激分泌更多的细胞因子。因此,表达MSLN-28Z和MSLN-28BBZ的T细胞被用于后续的体内抗肿瘤研究。
这些体内研究使用的是人源异种移植的(PDX)模型,该模型是将病人肿瘤组织直接植入小鼠体内,无需进行体外建立细胞系的阶段。这些模型没有在塑料培养皿上培养过,从而能更真实地反映出患者肿瘤的组织和分子病理学以及药物反应。因此,PDX模型在评估体内疗效时比“传统”异种移植模型更具有预测性和临床代表性。
免疫染色法证实PDX肿瘤上表达MSLN,用表达MSLN- 28Z和MSLN- 28BBZ的CAR-T细胞处理PDX模型。结果显示与正常T细胞相比,CAR-T细胞能显著抑制肿瘤的生长,并降低肿瘤的平均重量。总之,该结果表明MSLN靶向T细胞可以消除PDX模型的胰腺肿瘤。
抑制肿瘤活性的效果与MSLN特异性CAR-T细胞在体内的存活有关,这些CAR-T细胞被转入间皮素阳性的胰腺癌PDX模型。
小结
本研究表明,抗MSLN靶向CAR-T细胞能有效抑制PDX模型中胰腺肿瘤的生长。CAR-T细胞疗法有望成为胰腺癌患者的一种新的治疗手段,目前胰腺癌患者可选择的治疗方案有限,且疾病预后较差。