在2018年ENA大会上,向与会者展示了来自我们一系列的肿瘤免疫(I/O)平台的最新数据。其中4张海报着重介绍了小鼠肿瘤免疫(I/O)模型。本文回顾了原位细胞系同种移植模型和原位前列腺肿瘤同种移植模型的海报,及两种模型原位和皮下移植瘤的特征和TIL分析。
利用前列腺肿瘤同种移植模型评估免疫联合疗法
ENA海报250:为评估免疫联合疗法,建立小鼠前列腺肿瘤同种移植模型。
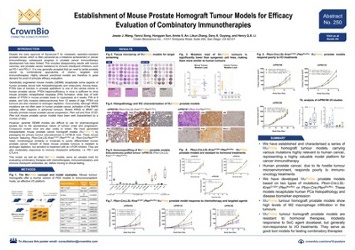 许多ENA 2018海报中都有介绍我们的新型肿瘤同种移植平台。肿瘤同种移植模型具有GEMM模型靶向性的优点,同时操作方便简单,易于进行药效学研究。
许多ENA 2018海报中都有介绍我们的新型肿瘤同种移植平台。肿瘤同种移植模型具有GEMM模型靶向性的优点,同时操作方便简单,易于进行药效学研究。
ENA海报250重点关注的是我们最新的前列腺肿瘤同种移植模型,可用于免疫疗法和联合疗法的开发。
前列腺癌临床前药物研发
前列腺癌迫切需要新的治疗方案,最有前景的是包括免疫疗法(除了Sipuleucel-T外,其他均在这种癌症中表现不佳)、化疗和靶向制剂在内的联合疗法。
因此,需要有临床前模型来测试这些联合疗法。这些模型需要有健全的免疫系统以满足免疫治疗药物的开发,同时还需要有与人类疾病发生相关的基因突变及分子特征。
虽然基因改造的免疫健全前列腺肿瘤模型能够很好的复制人类疾病的特征,但并不适合用于药效学研究,因为其肿瘤会发生在不同的时间点。
复合突变小鼠的特征也很明显,但繁殖成本很高。
前列腺肿瘤同种移植模型
我们的肿瘤同种移植模型是通过将特征明确的小鼠原发瘤皮下转接至同种小鼠而构建的。我们在海报中详述了这些前列腺癌模型,具有Pbsn-Cre;LSL-KrasG12D/+、Ptenflox/flox 或Pbsn-Cre、Ptenflox/flox的特征。这些模型具有健全的免疫系统,形态学上类似于中至低分化的人类疾病,易于操作,适合于药效学研究。
海报描述了表征和突变负荷数据(与细胞系同种移植模型相比,肿瘤同种移植模型的突变负荷较低,更接近人类疾病的突变负荷),然后转至用激素和靶向制剂、化疗和免疫疗法的药效学研究。
这三个模型对药物的反应和治疗方法放在一起来讨论。这些模型对激素治疗一般都耐受,对mTOR抑制剂的反应更好。对常见免疫检查点抑制剂(抗PD-1和CTLA-4)的反应较差,这说明联合疗法可能是前列腺癌免疫治疗的未来方向。
综上所述,肿瘤同种移植模型具有临床相关特征和健全的免疫系统,为前列腺癌免疫治疗药物研发提供了一个全新平台。
细胞系同种移植模型在免疫肿瘤(I/O)药物研发中的应用
ENA海报241:利用小鼠细胞系同种移植模型进行肿瘤免疫(I/O)药物研发:模型选择及数据阐释的广泛应用和指导
 下一张海报重点关注细胞系同种移植模型。我们经常展示我们的MuScreen™,这是首个也是最成熟的可供免疫疗法研发的体内同种移植模型筛选平台。之前的海报已经介绍了药效学实验结果,这里我们重点关注细胞系同种移植模型的特征,以帮助设计研究方案和选择模型。
下一张海报重点关注细胞系同种移植模型。我们经常展示我们的MuScreen™,这是首个也是最成熟的可供免疫疗法研发的体内同种移植模型筛选平台。之前的海报已经介绍了药效学实验结果,这里我们重点关注细胞系同种移植模型的特征,以帮助设计研究方案和选择模型。
细胞系同种移植模型特征
要想真正理解免疫调节与抗肿瘤表型之间的相互作用,需要知道细胞系同种移植模型的具体特征。这一特征需要能够捕捉免疫检查点药物处理后荷瘤小鼠不同组织的免疫细胞的动态变化及免疫细胞浸润情况。
为了表征MuScreen模型,我们用抗PD-1抗体对模型进行治疗,然后评估抗肿瘤效果及血液、肿瘤和其他免疫器官中的免疫表型变化。我们2018年ENA海报中展示了选定肿瘤模型中基础水平的免疫细胞亚群肿瘤浸润及免疫分析的初步数据。
细胞系同种移植模型的免疫分析结果
我们全面的细胞系同种移植模型表征揭示了一些有趣的结果。多个方面都出现差异性,包扩每个模型基础水平的免疫细胞浸润,以及PD-1阻断后个体小鼠的免疫表型变化。
每个细胞系同种移植模型的免疫细胞浸润程度不同。根据肿瘤免疫(I/O)治疗制剂的作用机制或目标免疫细胞,这些数据可用来指导研究人员选择合适的模型。
在抗PD-1治疗之后反应良好的模型,明显有免疫调节变化趋势。然而,在对治疗反应较弱或对治疗耐受的模型中,我们并未发现这一点。
总体来说,我们正在编制的特征数据,揭示了抗肿瘤反应相关免疫分析的动态变化。这些数据对选择模型或选择哪些药物继续后续联合治疗评估等战略决策的制定有很大帮助。
用原位细胞系同种移植模型再现肿瘤微环境
ENA海报329:利用生物发光基因标记的细胞系构建同种移植模原位瘤模型,重现肿瘤免疫微环境,以评估免疫检查点抑制剂的疗效
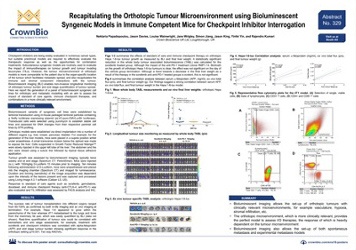 我们为使细胞系同种移植模型更适于药物研发所做的另外一个努力是开发原位瘤模型。对免疫治疗的反应很大程度上依赖于肿瘤微环境(TME),同种移植的原位瘤模型由于其特异的肿瘤移植位置而有更类似于病人的TME。原位瘤模型可以发生肿瘤转移,更好的再现肿瘤微环境中的免疫和基质组分。总体来说,这可为免疫治疗评估提供与临床更具相关性的模型。
我们为使细胞系同种移植模型更适于药物研发所做的另外一个努力是开发原位瘤模型。对免疫治疗的反应很大程度上依赖于肿瘤微环境(TME),同种移植的原位瘤模型由于其特异的肿瘤移植位置而有更类似于病人的TME。原位瘤模型可以发生肿瘤转移,更好的再现肿瘤微环境中的免疫和基质组分。总体来说,这可为免疫治疗评估提供与临床更具相关性的模型。
生物发光基因标记的细胞系同种移植模型
如这份海报中报道的,我们已经构建了生物发光的原位同种移植模型。这样可对肿瘤负荷进行非侵入性纵向监测,对肿瘤扩散做出终极量化。
该海报重点关注Hepa 1-6-lux模型,详细介绍了索拉非尼标准治疗及抗PD-1抗体治疗。索拉非尼治疗可显著降低与全身肿瘤相关的生物性发光,抗PD-1治疗组也有降低趋势。
转移模型
生物性发光成像的另一个优势是易于量化转移灶。海报还介绍了4T1模型,该模型在乳腺脂肪垫原位转接后可扩散至肺和骨。
综上所述,使用原位同种移植模型可为免疫治疗试验提供与临床更具相关性的TME,且便于建立自发性转移和试验性转移模型。
在同种移植模型的原位肿瘤中免疫细胞浸润模式不同
ENA海报313:与皮下肿瘤相比,同种移植模型(同基因)的原位肿瘤具有特异的免疫细胞浸润模式
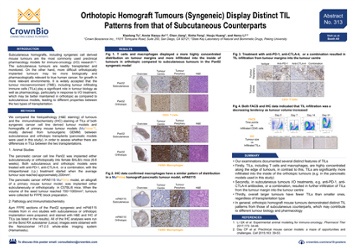 我们最后一张关于小鼠肿瘤免疫模型的海报仍重点关注原位同种移植模型,回顾了免疫分析和肿瘤同种移植。
我们最后一张关于小鼠肿瘤免疫模型的海报仍重点关注原位同种移植模型,回顾了免疫分析和肿瘤同种移植。
如前所述,皮下模型通常用于临床前肿瘤免疫(I/O)药理学研究,但原位肿瘤维持较佳肿瘤微环境(包括肿瘤浸润免疫细胞),同时更加贴近人类疾病。
这篇海报对原位及皮下移植的胰腺癌细胞系同种移植模型和肿瘤同种移植模型的免疫细胞浸润(TILs)情况进行了比较。
原位肿瘤中独特的肿瘤细胞浸润模式
组织病理学和免疫组织化学(IHC)结果表明,原位和皮下移植的细胞系同种移植模型及肿瘤同种移植模型的TIL模式存在明显差异。主要区别在于,与皮下移植瘤相比, TILs(如T细胞和巨噬细胞)明显更易于浸润至原位肿瘤内部。
有趣的是,对于皮下移植瘤,免疫检查点抑制剂(如抗PD-1或抗CTLA-4)治疗会导致从肿瘤边缘向中心的TIL浸润增加。
与小肿瘤相比,我们也能发现无论原位还是皮下移植,在大肿瘤中TILs会更少。
总体来说,不同的肿瘤生物学和药理学可能与原位移植瘤模型特异的TIL模式相关,这一点在免疫治疗评估研究中应予以考虑。
更多与ENA 2018相关的内容
本周ENA大会有10张海报不容错过,也不要错过ENA 2018最新人源化模型和人源肿瘤异种移植(PDX)的演示内容。










