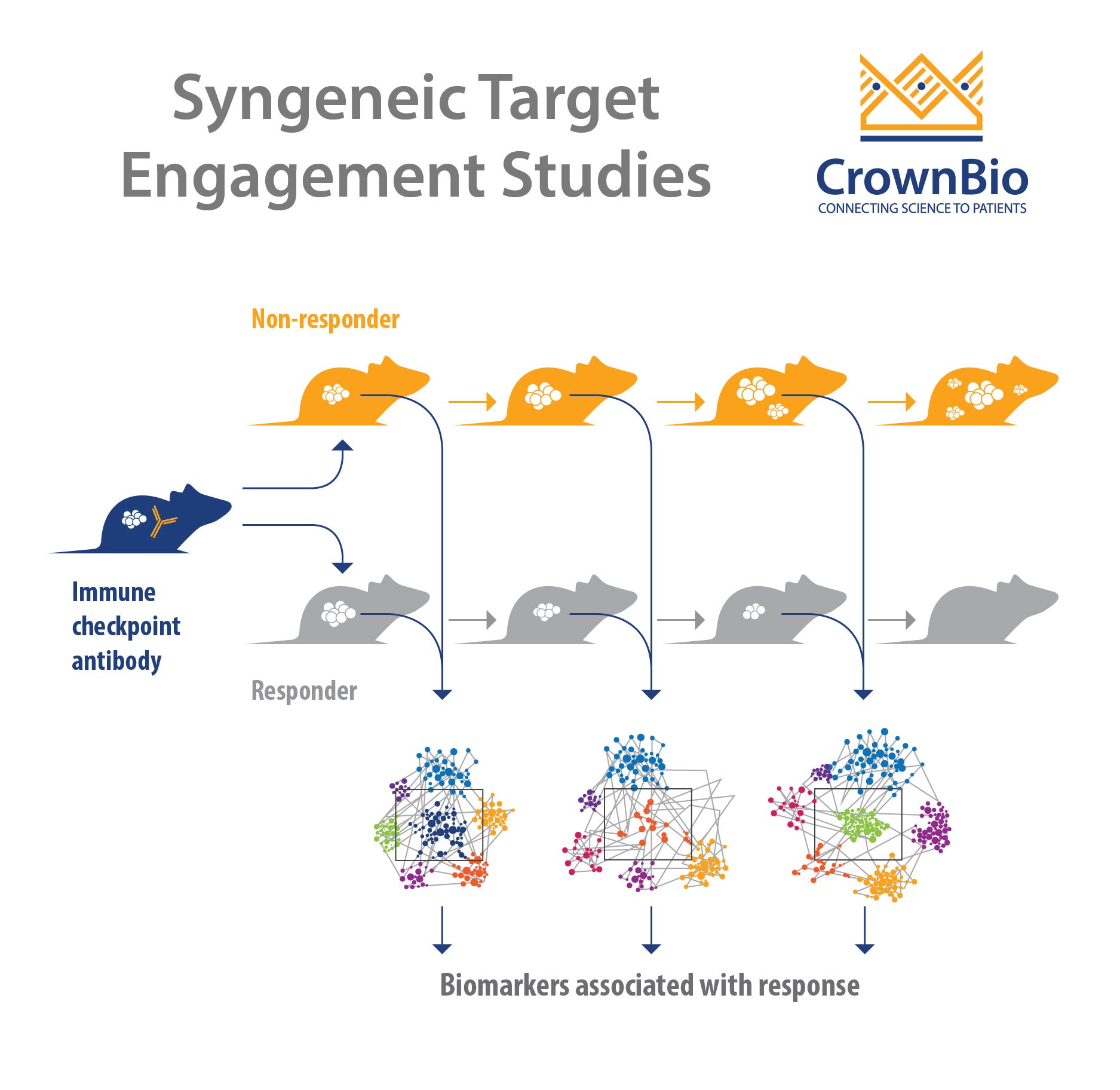
同源肿瘤模型是新药研发的一种选择,速度快,通量高。下面介绍如何利用同源肿瘤模型进行免疫治疗靶向参与研究。
何为靶向参与研究?
在靶向参与研究中探讨新药研发的作用机理(MOA)和药效学(PD)原理。通常情况下,这些要通过概念性验证(POC)研究在确定可行性方法之后再进行。
靶向参与研究旨在确定生物指标及其相关终点。这些终点虽不能直接表现临床效果,但却有助于预测结果。因为相关终点值似乎能影响患者对免疫疗法的反应,近年来,相关终点值鉴定也随之升温。
免疫治疗靶向参与研究
各种免疫治疗性质极为复杂,显然不适用于常规临床试验规则。也就是说,作用机理(MOA)和药效学(PD)相关的预测反应标准需要重新制定。
例如,越来越多的证据表明,临床试验终点,如RECIST显示的总体反应率及存活率,可能低估了免疫肿瘤试剂的疗效。另外,将PD-L1表现用作生物指标,尚不足以完全解释为什么PD-L1肿瘤表现不明显的那些患者反而临床疗效持久。
与化疗之类的常规疗法相比,免疫靶向试剂的复杂性主要在于其非线性剂量反应动力学原理。免疫肿瘤试剂最初通过免疫细胞或恶性细胞上的分子靶向参与发挥疗效。然后引发免疫信号通路,明显涉及通过多种细胞类型(如抗原呈递细胞、MDSCs、T细胞等)繁殖的顺序步骤,最终致使恶性细胞死亡。
这与常规药效学(PD)形成鲜明对比,其中药效含在单个靶向细胞之内,疗效也更加直接。
为何要使用同源模型?
为了评估免疫治疗靶向参与,必需要有一个活性免疫系统。利用同源模型可评估小鼠代孕免疫肿瘤试剂的作用机理(MOA)和药效学(PD)原理。
为了设计一项较为全面的综合靶向参与研究,必需要记下时间点和同生群。因为大规模建立同源模型时间短且成本低廉,为了实现这一目标,同源模型较为理想。
如何使用同源模型进行靶向参与研究
对已治愈/未治愈或有反应/无反应动物的免疫和基因组分析加以表征,确定试剂的作用机理(MOA)和药效学(PD)性能。
在选择模型时,注意肿瘤模型不同,具有的浸润免疫细胞数量和类型基线也不相同。此外,基线可随肿瘤恶化程度变化。
例如,在7日内,荷瘤模型可按下述顺序进行:
- 基线高位肿瘤浸润免疫细胞至整体低位免疫细胞。
- 比例由高到低的M1巨噬细胞和调节性T细胞。
上述因素都要经过深思熟虑。根据概念性验证(POC)研究所示的模型治疗反应,上述因素可为潜在的预测性生物指标提供观察视角。
此外,用RNAseq进行肿瘤基因表达分析,获取特殊疗法如何及是否形成肿瘤基因表现。RNAseq分析还能确定反应的主要特征。
最后,利用同源模型研究免疫药效学(PD) 针对治疗的相关变化。下游评估会影响(即在免疫群体中或细胞因子变化)后靶向参与,有助于揭示试剂的作用机理。
使用同源模型进行靶向参与研究遇到的挑战
我们之前曾讨论过,肿瘤生长动力学中存在变异性,主要是由于免疫系统极其复杂,其肿瘤发生相互作用。毋庸置疑,相同治疗组中个体肿瘤免疫表型之中存在变异。
与设计概念性验证(POC)研究相似,统计数据有助于为重要靶向参与分析确定所需动的物数量。在概念性验证(POC)阶段了解疗效变异性程度是关键之所在。在后续靶向参与研究中,这有助于获取统计数据所需的动物数量(“n”)。疗效越好,获取统计数据所需的小鼠数量就越少。
例如,如果在概念性验证(POC)阶段能看到所有小鼠对试剂都有反应,那么靶向参与研究设计则极其简单——评估对照组和治疗组小鼠之间生物指标的差异性即可。
另一种情况,如果有反应和无反应小鼠混在一起,就要在有反应和无反应小鼠之间评估潜在生物指标的差异性。因此,参数的n值要高一些。
切记只有一个重要因素,很难跟踪个体动物的药效学(PD)。流式细胞术主要是一个端点分析,即同一动物不能在后续时间点使用。因为活组织检查不能完全代表肿瘤的异质性,所以通常要避免使用活组织检查。
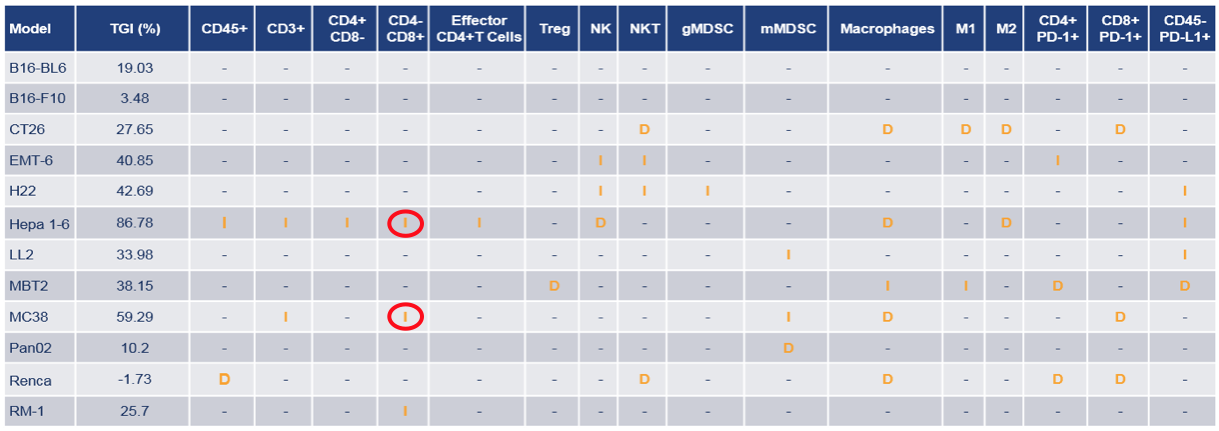
尽管肿瘤浸润淋巴细胞(TIL)在临床环境中更具预测性,但是外周血取样仍是解决端点肿瘤浸润淋巴细胞(TIL)取样局限性的一种方法。否则,平均值常用于在指定点及时测量药效学(PD)和疗效(TGI)之间的相关性,请看下述实例。
【表格名称/信息】:带有不同平均疗效(TGI)(%)的一组同源模型,用PD-1抗体治疗后在第13日,治疗组和对照组之间的免疫细胞群体百分比平均值存在明显差异
在分析时,肿瘤大小也要考虑在内。由于细胞坏死,大肿瘤的活性与流式细胞术门控策略可能会受到一定影响。如果希望能把免疫指标与反应相互关联,要在疗效研究端点进行取样,这样就可能会为对照组((对照组可能比治疗组生长快)带来问题。因为有了这一局限性,就要把模型逐个严格优化,在靶向参与研究中推荐使用取样指导原则。
最后,尽管大多数同源肿瘤模型都能提供2-3周的治疗窗口,但要想观察某些免疫反应,2-3周的时间尚显不足。根据非线性反应动力学原理,反应特征或任何潜在的副作用随后都可证明远远超过了可用的动物保护端点标准。Pan02等模型生长速度较慢,有助于解决这一问题。否则,用治疗组动物换掉对照组动物继续研究。
未来方向?
一项成熟的靶向参与研究,可揭示客户试剂的药效学(PD) 和作用机理(MOA),指导把生物指标纳入免疫治疗临床试验。把免疫表型和基因组分析整合,还有助于为对免疫治疗反应更强烈的患者进行确诊。
越来越多的证据表明,单一生物指标(如PD-L1)尚有不足之处。作为下一步计划,客户可能会希望采用元分析法来评估多个免疫指标和反应之间的相关性。或者,客户可在各细胞生物学意义的背景下参考各个生物指标之间的空间关系。
最后,接受免疫肿瘤试剂潜在的复杂生物反应,定能使客户临床走上成功之路。