探索来自健康组织和肿瘤的类器官与3D生长的原代细胞之间的主要差异。
建立3D培养的体外方法
体外系统是基础研究以及药物研发的重要工具。从历史上看,已经使用了常规的2D细胞培养方法,但现在,先进的3D体外培养系统已得到越来越广泛的应用。
尽管2D培养物在塑料上以扁平单层形式增殖,但3D体外培养允许3D环境中细胞之间进行复杂的空间交互。这更好地体现了体内细胞间接触和原生理状况。反过来,这又提供了更相关的微环境,影响细胞进程和治疗反应。使用新鲜的原代癌细胞时,3D培养对于提高建立体外模型系统的成功率也很重要。
可以使用临床的细胞系或组织提供多种3D体外模型选项。由于缺乏2D细胞系可译性,临床来源的组织是金标准,并以不同方式用于开发模型研究系统。这包括生成复杂的类器官和3D原代培养物。
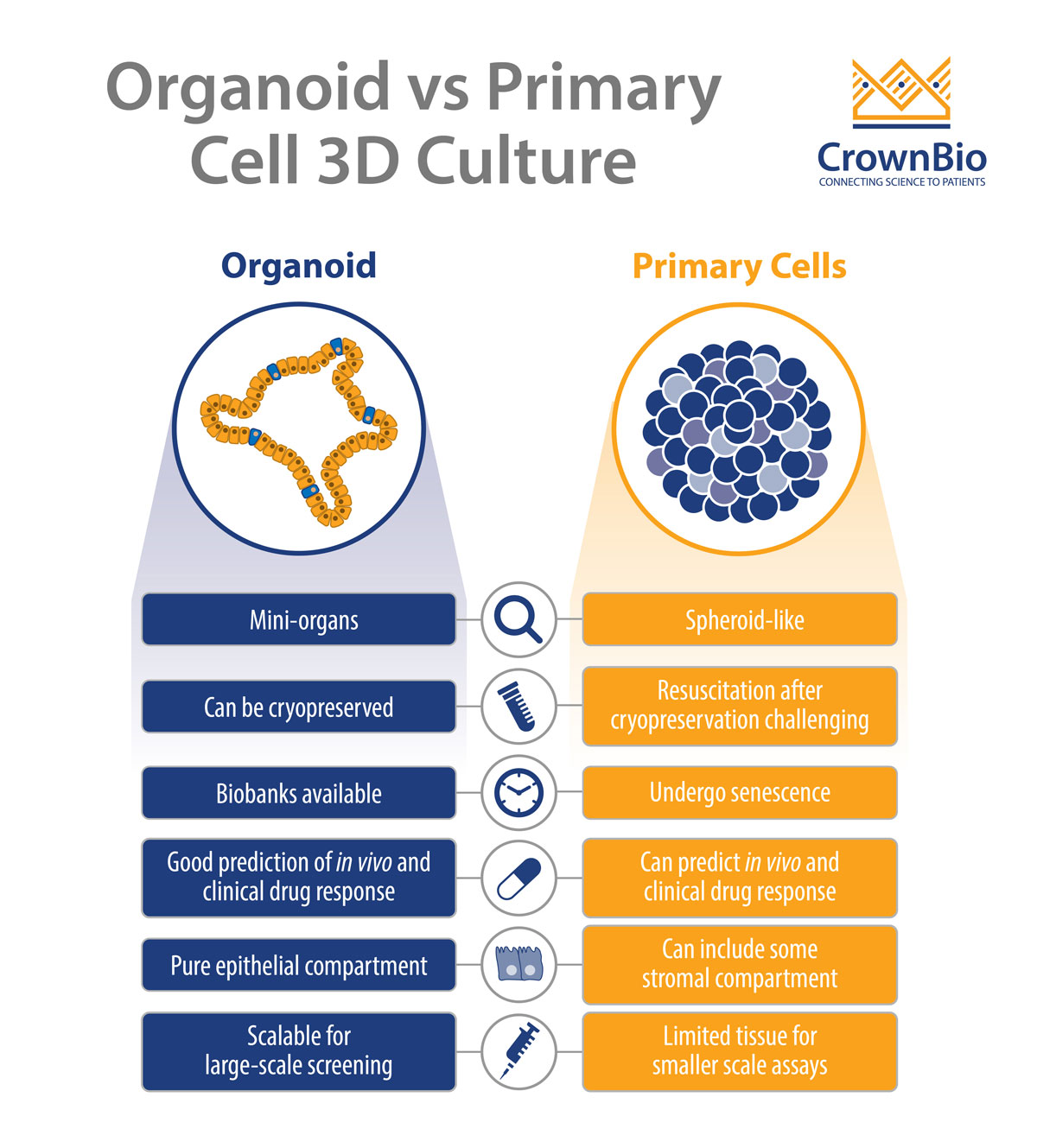
由于这两种模型都是直接从患者组织(包括肿瘤)中生成,因此它们可以更好地反映原组织的遗传组合和基因表达谱。但是,类器官和3D原代细胞之间存在一些关键差异,这些差异会影响每种模型类型的典型应用,下面将对此进行评论。
类器官的关键特征
我们之前已经讨论过类器官从器官内成体干细胞(ASC)或胚胎干细胞(ESC) 衍生而来的典型方式,以及Hubrecht Organoid Technology(HUB)如何针对健康和患病组织(例如,肿瘤)改善该过程。
简而言之,类器官是:
- 自组织——这是类器官的关键特征,可导致由干细胞或祖细胞形成多细胞结构,并表现出与体内器官架构的显著相似性。类器官在生理学方面高度相关,包含多个分化的细胞谱系,这些谱系相互作用并建立细胞间接触,从而复制体内过程。
- 基因组稳定——由于类器官来自干细胞,并保持在特定培养条件下,它们体现了原组织的基因组组合,并在多次传代中显示出基因组稳定性。
- 自我更新——这意味着类器官可以增殖和冷冻保存以建立生物样本库,并在不影响遗传同一性的情况下进行复苏以进行重复研究。
使用HUB技术,可以很容易地生成、扩增和存储类器官和肿瘤类器官,以及扩大规模以用于包括大规模药物筛选等药物开发应用。
肿瘤类器官
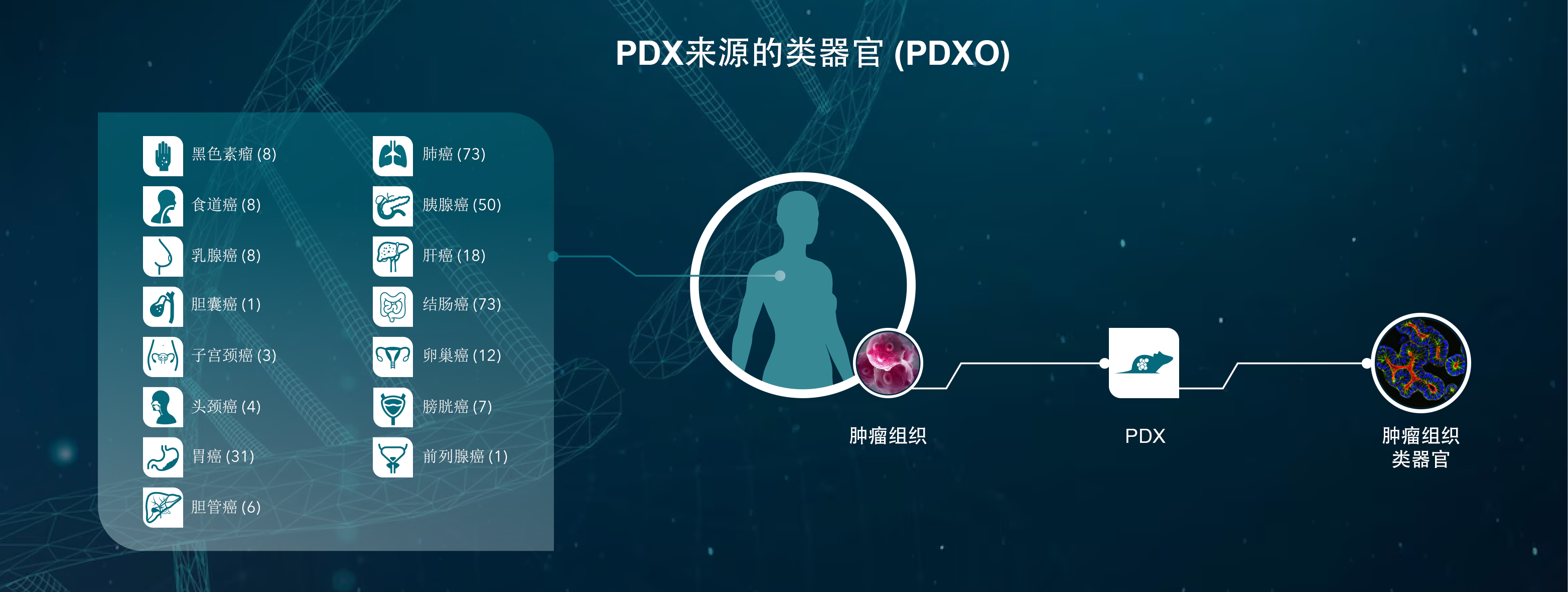
肿瘤类器官来自多种来源——临床患者样本、病人异种移植肿瘤模型(PDX,在小鼠中生长)以及鼠肿瘤组织。PDX来源的肿瘤类器官被称为病人异种移植肿瘤类器官(PDXO),为患者组织提供了ASC的替代来源,这在模型开发中可能具有限制性。
由患者肿瘤和PDX形成的肿瘤类器官都保留了原肿瘤形态和遗传特征,例如基因扩增、体细胞拷贝数和突变。
重要的是,患者相关的肿瘤类器官还可以在临床中复制患者反应,这为其所有应用增加了高度可译性。
PDXO的其他优点包括快速开发多种癌症类型、亚型的大量模型,以及现有大量PDX模型的突变模型。这些PDXO模型捕获了在临床癌症人群中观察到的异质性和多样性,而常规体外细胞系模型做不到这一点。
3D原代细胞培养物的关键特征
3D原代细胞培养物利用直接从组织获得并在基于支架或无支架的系统中生长的细胞。建立来自单个组织或不同组织类型(包括患病组织或肿瘤)的单个细胞类型或多细胞混合物的培养。
原发性肿瘤细胞
与常规细胞系相比,预期原发性肿瘤细胞将更接近原组织,其关键特征如下:
- 原代细胞尚未被永生化或适应体外生长,因此可以更好地体现原肿瘤的基因组和表达谱。
- 在3D模式下,原发性肿瘤细胞复制了亲代肿瘤组织架构,比2D模式更忠实地复制了细胞进程和治疗反应。
从肿瘤中获得的原代细胞也可以在无支架的系统中培养,产生名为“肿瘤球”的自由浮动球体。与其他类型的原代细胞聚合物不同,肿瘤球在含有更多分化细胞的3D中进行培养,富含具有癌症干细胞(CSC)特性的细胞。
使用原代细胞的其他类型测定包括甲基纤维素克隆形成、软琼脂克隆形成和3D肿瘤生长测定(3D TGA),这些都是针对特定目的的测定。例如,3D TGA 研究肿瘤微环境(TME)在药物反应中的作用。它涉及将肿瘤细胞包埋在低刚性细胞外基质(IrBME,Cultrex®)中并与hMSC(例如IL-6,HGF)或CAF共培养以模拟实体瘤TME中存在的旁分泌信号。
类器官和3D原代细胞培养物之间的差异
虽然类器官和3D原代细胞培养物均可来源于患者,但模型类型之间存在关键差异。
培养条件
类器官来源于干细胞,并在非常特定的培养基中培养以确保适当的类器官生长和发育。这是通过优化培养物生长条件来实现的,例如提供基底膜基质(即Matrigel®)并添加一系列激动剂(例如Wnt和酪氨酸激酶受体)和抑制剂(例如骨形态发生蛋白/转化生长因子-β)。
HUB已微调了这些生长条件,从而可以从一系列癌症类型的癌症干细胞中产生肿瘤类器官。还可以从匹配的健康组织获得类器官,以更好地控制实验数据。
使用HUB建立方法开发的类器官为上皮来源。另一方面,原代细胞培养物主要由分化细胞组成,并且培养条件因培养物而异,这导致从某些癌症类型建立稳健的培养物更具挑战性。
架构
类器官依赖于复杂的自组织过程,从而形成“微型器官”。相反,原代细胞在施加物理或机械力(例如搅动)时通过简单的细胞间粘附产生多细胞结构,类似于球状体而不是器官样结构。
长期维持
培养中细胞的长期体外扩增需要不成熟的干细胞种群来补充濒临消亡的细胞。由于类器官来自体外培养过程中的干细胞群并维持此干细胞群,因此能保证其长期生存能力。类器官还可以在多次传代中保留细胞组成、架构和遗传特征。
相反,原代细胞的典型培养条件并未针对体外培养的长期维持进行优化,细胞在经过数次传代后趋于衰老或漂移。
生物样本库
类器官已成功地冷冻保存,可以在不损害其基因组和形态特征的情况下,作为离体生物样本活库保存下来。这使得生物样本库可用于重复研究。
相比之下,原代细胞更像是一次性解决方案。尽管原代细胞可以冷冻用于重复研究,但它们更难以成功复苏,因此重复研究需要回到原肿瘤组织中重新获取细胞。
混合物筛选
由于上述关键特征,因此可以扩大肿瘤类器官规模,以进行大规模体外药物筛选,其临床相关性高于当前的体外HTS平台。与体内筛选相比,以这种方式同时进行多种候选药物和组合的大规模筛选可节省时间、精力和金钱。
原发性癌细胞可用于在简单3D测定系统中评估抗癌药的疗效。与类器官类似,可以直接从患者肿瘤或PDX模型建立细胞。如果使用PDX,则在使用前应清除细胞中的任何小鼠基质成分。
匹配的体内模型
将体外类器官模型与匹配的体内模型(例如PDXO和匹配的PDX)配对,可为更好促进体内模型选择提供一个平台,并允许使用与患者高度相关的匹配平台从体外研究过渡到体内研究。
由于并非总是有原代细胞培养物匹配的体内模型,因此将原代细胞发现推进到体内研究需要额外的步骤来识别合适的模型。
结论
类器官和3D原代细胞培养物均优于传统的2D单层培养物,因为它们为细胞间相互作用和细胞反应提供了更具生理学相关性的环境。两者均已被成功地用于利用临床组织作为体外模型系统,并且正在被更广泛地应用,特别是在癌症药物的开发和发现中。但是,类器官和3D原代细胞培养物之间存在一些关键差异,需要了解才能选择最佳的研究应用。
3D原代细胞培养系统与2D单层培养相比能更好地体现体内特征,并提供了一个简单易用的平台来评估新型候选药物的疗效。
但是,相比之下,干细胞来源的类器官具有其他优势,包括原器官的生理学相关性,对健康和疾病组织的长期体外培养的顺从性,提供干细胞和分化子代的异质培养,扩增以获取组织的生物样本活库,HTS以及更忠实地预测患者反应。
在药物开发中采用类器官可以在体外和体内实验室理念中具体体现患者特点,并可以加快朝着临床受益的正确方向做出决策的速度。