探索肿瘤类器官在临床前癌症药物开发(受肿瘤类器官模型驱动)中的主要应用。
肿瘤药物开发中的肿瘤类器官
所有治疗领域中,肿瘤药物开发的失败率一直处于最高水平。尽管这种高失败率由多种因素造成,但这也证实了需要更具有临床相关性的临床前模型。体外药物开发中肿瘤类器官的应用部分地满足了这一需求。类器官技术的兴起,彻底改变了现有3D和2D体外模型的体外可预测性,同时指导研究人员在后期研究中使用最佳体内模型。
肿瘤药物开发中肿瘤类器官的4项应用
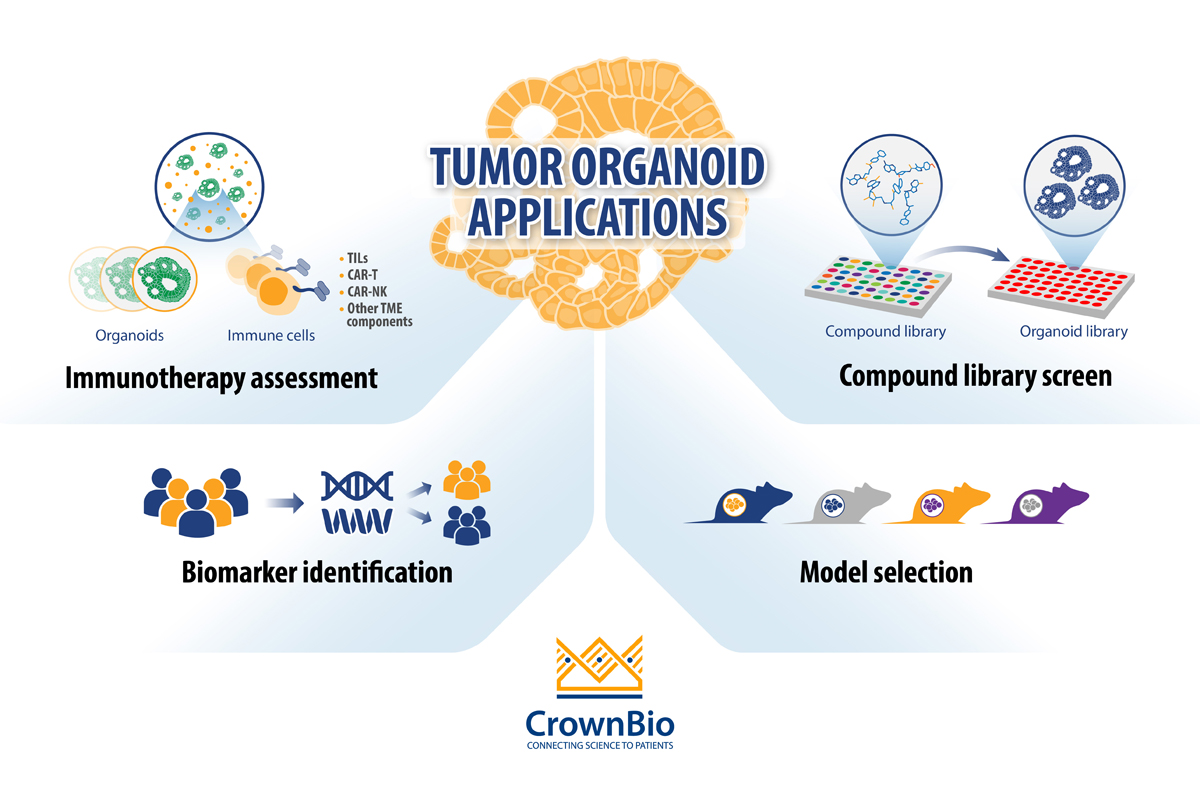
目前,癌症药物开发中肿瘤类器官的主要应用包括:
- 化合物库筛选: 通过使用广泛且表征良好的肿瘤类器官生物库,体外“匹配记录”的患者相关性得到增强,并且可快速鉴别能够快速过渡到相关体内模型的先导药物。
- 生物标志物鉴别:通过对肿瘤类器官基因突变状态与其匹配的健康对应物进行比较,或对肿瘤类器官亚型(源自不同癌症类型)之间进行比较,对差异表达的候选生物标志物进行评估。通过使用肿瘤类器官生物库,捕获在患者人群中观察到的表型和基因多样性,并且药物应答可与突变状态相关联。
- 体内模型选择:通过使用肿瘤类器官集(生物库),研究人员可将分子和表型图谱纳入到他们的体内模型选择过程中,进而增加所选PDX模型的适用性。
- 通过与免疫细胞进行共培养,进行免疫疗法评估: 肿瘤类器官共培养开发用于免疫肿瘤学应用 ,目的是提供另一个与癌症细胞系相比更具有临床相关性的临床前平台。自体和非自体细胞都用于肿瘤类器官共培养的开发。
肿瘤类器官模型的主要特征
这些扩增应用受到肿瘤类器官主要属性的推动。所有临床前模型都具有各自的优缺点,但是肿瘤类器官具有一些不同特征,这些特征使其与其他3D培养系统区分开来,并使肿瘤类器官成为目前可用的最具有临床相关性的体外选项。
使类器官与其他3D体外模型区分开来的主要属性有:
- 3D结构的来源:来源于干细胞的类器官存在于成人上皮组织中。得益于特定的培养条件,这些干细胞能够自我更新并体外区分,形成自组织的多细胞3D结构。与健康类器官类似,肿瘤类器官忠实地体现了在人体癌症组织中观察到的复杂性,包括癌症干细胞(CSC)及其下游分化子代。
- 动力的性质:由于类器官来自干细胞,其形成主要受到内在发育项目的推动,这些发育项目显著体现了组织生理学和器官架构。
- 3D培养可以维持的时长:类器官可在体外长时间成功培养。重要的是,即使在传代、扩增以及低温保存之后,类器官也能在多代内保留原器官或肿瘤的表型和遗传学特征。
- 体现肿瘤组织的复杂性: 使用专用HUB方案建立的肿瘤类器官,忠实地体现了在原始肿瘤中观察到的关键表型和遗传学特征。HUB方案还防止CSC快速耗尽,进而使其能够在体外长期维持。
- 匹配的体外和体内癌症药物研究平台:通过患者活检标本或有良好注释的PDX模型库,开发肿瘤类器官的生物库。这为癌症药物发现和开发提供了一个独特的临床前平台。研究人员使用肿瘤类器官生物库进行大规模药物筛选和药物组合检测,并且可以轻松过渡到体内模型,用于后期研究。
结论
根据模型特性,肿瘤类器官是肿瘤学研究中最具有临床相关性的体外模型。这些特性使肿瘤类器官能够在肿瘤药物开发中进行新的应用,从而增强体外药物开发阶段早期的预测性,并有助于过渡到体内模型,用于后期研究。
总体上,在这些应用中,肿瘤类器官的患者相关性越高,生成的研究抗癌药物的疗效和药效相关的数据更为准确,最终增加了下游研究的成功几率。