在本博客中,我们将探讨免疫介导的炎症性疾病(IMID)——一类以过度和(或)不当免疫反应为特征的疾病。由于IMID具有同样的炎症通路,所以在一种IMID中起作用的新疗法可能在其他IMID中同样起作用。因此,近年来,人们对这一类疾病的研究兴趣迅速上升。通过继续阅读本文,可以了解更多关于IMID和该领域面临的一些挑战,并回顾一些可用于指导IMID药物研发的体内临床前模型。
什么是免疫介导的炎症性疾病?
免疫介导的炎症性疾病是一大类临床上不相关但具有共同的病理生理学基础的疾病,即都是由过度活动或异常免疫系统调节引发。这些异常会导致目标器官的慢性炎症和一系列疾病,这些疾病均被列为导致残疾、经济损失和过早死亡的头号杀手。
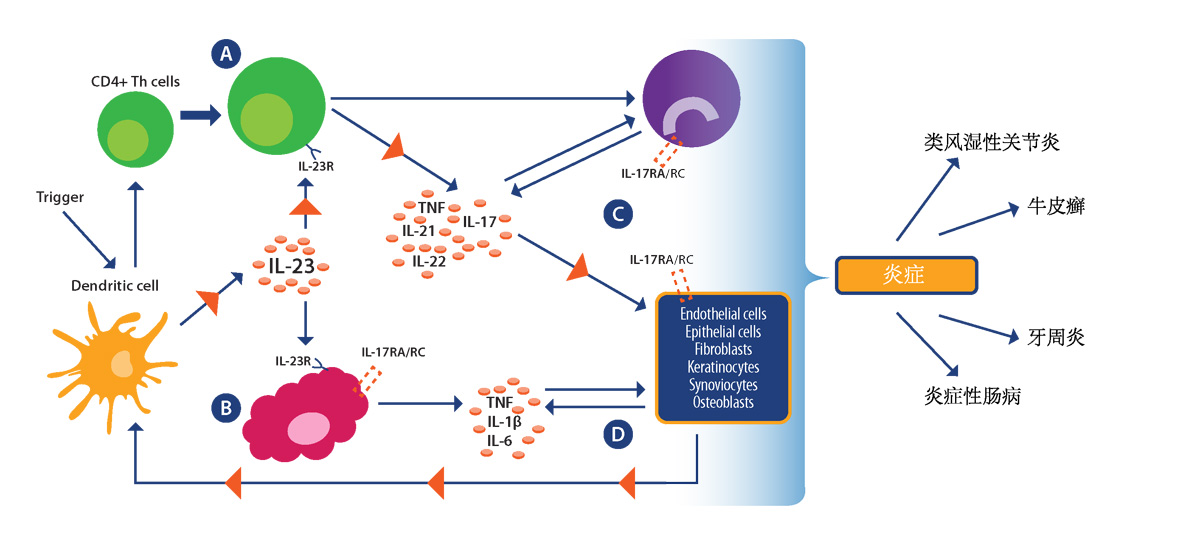
尽管IMID的确切原因的谜团尚未解开,但它们被认为是由基因、环境和传染病因素之间的复杂相互作用引起的,这些因素导致了功能失调的免疫反应。目前的研究表明TH1细胞是IMID炎症过程的关键驱动因素,新证据也支持CD4+辅助性T细胞的TH17亚群和相关促炎性IL-17/IL-23轴的作用(见下图)。
采用 Bunte and Beikler.在 Int J Mol Sci. 2019:20:14.中发表的图片重新绘制,在MDPI的指导下使用,不需要特别的许可来重用已发表的文章的全部或部分。
在大量的IMID治疗中,抗炎剂取得了极大的成功,这证实了这些疾病具有共同的病理生理学特征。IMID几乎对人体每个器官系统都表现出针对性,因此,如今越来越多的炎症状态被归为IMID范畴(见下表)。
| IMID的例子 | |
|---|---|
| 炎症性肠病(IBD) 【克罗恩病和溃疡性结肠炎】 |
1型糖尿病(T1D) |
| 哮喘 | 桥本氏甲状腺炎 |
| 慢性阻塞性肺疾病(COPD) | 类风湿性关节炎 |
| 多发性硬化 | 移植物抗宿主病 |
| 牛皮癣 | 感染疾病 |
| 系统性红斑狼疮 | 血管炎 |
| 甲状腺疾病 | 心血管、肾脏和代谢疾病 |
炎症反应和癌症的关系
众所周知,慢性炎症是一种致瘤的风险因素,且被普遍认为是肿瘤发生的标志之一。例如,对患有克罗恩病的患者来说,其患结肠直肠癌和其他胃肠道恶性肿瘤的风险会增加,而患有1型糖尿病会增加患者患胰腺癌的风险。活性氧和氮对DNA的破坏作用被认为是炎症引发或促进癌症的主要机制。
然而,炎症在癌症中的作用是复杂的,因为炎症免疫反应本身也可能具有抗肿瘤的作用。炎症反应促肿瘤和抗肿瘤特性之间的平衡被认为依赖于免疫系统的适应性和固有性两方面特质的适当和平衡的激活。免疫功能低下患者中癌症发病率的高企,突出体现了免疫系统在检测和消除恶性细胞(即免疫监测)中的重要性。
利用免疫系统力量的新疗法一方面给癌症治疗方案带来了新的变革,另一方面,它们对人体也具有独特的毒副作用,包括可以诱导人体的自身免疫反应。如下图所示,可以设想一个正反馈循环,IMID和免疫疗法的毒副作用可以继续推动慢性炎症及其下游效应。
传统的IMIDs疗法主要是基于器官的治疗,其目的是缓解症状,而不是针对潜在的机制。现在,随着人们发现IMIDs具有共同的病理生理学特性,已经在开发和使用基于机制的治疗策略(如细胞因子治疗)的治疗方法开发方面获得了一些进展,例如细胞因子治疗法。其中的一个例子是抗TNF药物,这些药物在治疗类风湿性关节炎、炎症性肠病、银屑病和其他炎症性疾病中有效。
炎症性疾病的机遇和挑战
近年来,尽管针对IMIDs的治疗取得了很大的进展,但仍有许多患者无法得到有效的治疗,或在首次治疗成功后复发。
例如,尽管抗TNF治疗对于许多患者来说是有效的,据估计,抗TNF治疗对10-40%的炎症性肠病病人无效,在可以被有效治疗的患者中,继发性反应丧失可导致多达50%的患者需要加强治疗或停止治疗(12个月后)。
在过去的几十年里,有一种IMID的治疗方式发生了巨大的变化,那就是多发性硬化(MS)。现在至少有10种具有不同的作用模式的药物类别,“这反映了我们对MS病理生理学理解的进展”。
一种已被成功定位的IMID机制是免疫细胞转运,因为众所周知,免疫细胞浸润至中枢神经系统在MS的表现中起着重要作用。至少有两种已批准的MS疗法,那他珠单抗疗法和芬戈莫德疗法,已被证明可以选择性地干扰免疫细胞运输。此外,最近的一项分析表明,长期使用MS免疫疗法对改善患者因MS导致的残疾是有效的。
尽管抗TNF药物是目前被批准用于治疗广谱IMID疾病的唯一类别疗法,新的数据表明,Janus激酶(JAK)抑制剂——一种新型的靶向合成疾病改善抗风湿药物(DMARDs)可以干扰信号转导途径的各种细胞因子,可能在广泛的病理中介导免疫调节的有益作用。
目前有三种JAK抑制剂被FDA批准用于IMIDs治疗:
- 托法替尼治疗类风湿性关节炎
- 银屑病关节炎、溃疡性结肠炎和多关节幼年特发性关节炎
- 巴瑞替尼和乌帕替尼用于类风湿性关节炎
预计在不久的将来,适应症和新制剂的名录将会增加。
考虑到对许多IMID药物反应的异质性,在优化这些药物完成在精准医疗中的应用方面还有很大的潜力。完成这一工作需要详尽的了解不同患者群体之间发病机制的异同,这也是许多研发工作的重点。
炎症性疾病的临床前研究
临床前的体内研究模型在上述许多IMID药物的研究和开发中发挥了重要作用,这些模型正在继续为针对不同IMID的新型药物的研究和开发提供大量的资料。然而,选择最合适的模型是一个不小的挑战,没有一个单一的模型可以概括IMID的所有特征。
确定临床前研究最合适的模型需要了解治疗药物的预期靶点、研究目的和拟议的作用机制。在某些情况下,可以利用多种模型来评估安全性和有效性,并将临床失败的可能性降到最低。
以下是一些用于IMID药物开发的常用模型:
多发性硬化的临床前模型(MS模型)
实验性自身免疫性脑脊髓炎(EAE)模型是最早出现和最常用的MS模型。易感模型染色剂的发病率高,发病通常发生在9-12天后。由于人体的激活抗原尚不清楚,EAE是通过注射各种中枢神经系统组织抗原引起的,在这些组织抗原中,动物的病理表现与人类MS具有一些共同关键特征,如炎症、脱髓鞘、轴突损失和胶质增生。
许多被批准用于MS的治疗方法已经在临床前使用EAE模型进行了评估,但也存在其他的MS模型,包括过当转移EAE和Cuprizone诱导脱髓鞘模型。
在过继转移模型中,通过主动免疫供体模型产生的髓鞘特异性CD4 T细胞被注射到受体免疫抑制模型中。
Cuprizone诱导脱髓鞘模型使用口服铜螯合剂,以成熟的少突胶质细胞为靶点,绕过EAE模型的自身免疫成分。该模型提供了研究脱髓鞘(在5-6周时达到高峰)和从模型饮食中去除铜酮后发生的再髓鞘化的可能性。
炎症性肠病临床前模型(IBD模型)
通过使用各种特征良好的IBD实验模型可以研究炎症性肠病。这些模型的涉及范围从化学和微生物诱导、自发和过继细胞转移和基因工程模型(见这里不同模型的总结,包括它们的优点和缺点)。
根据想要研究的疾病(克罗恩病、溃疡性结肠炎等),选择与药物预期靶点的临床方案最接近的模型是很重要的(见我们关于选择正确的临床前IBD模型的白皮书)。
许多通常用于IBD一线治疗的小分子最初在实验性结肠炎模型中进行了试验,还有JAK抑制剂、细胞运输调节剂和新型类固醇。最近,实验性结肠炎模型在以微生物群为靶点的新疗法中展示了令人鼓舞的结果。
类风湿关节炎的临床前模型(RA模型)
RA模型被广泛用于评估研究药物。这些模型概括了临床和病理类风湿性关节炎的关键特征,这些特征可以用于确认治疗方案的疗效和反应,并用于选择下一个合格的类风湿性关节炎先导剂。两种常用型号包括:
- 胶原蛋白抗体诱导关节炎模型:通过给药商用的针对II型胶原的抗体诱导,导致RA迅速发病。
- 胶原蛋白诱导关节炎模型:DBA/1模型用II型胶原蛋白免疫,并使用不完全弗氏佐剂(IFA)增强,导致在IFA注射后的8-15天达到最严重病情
1型糖尿病临床前模型(T1D模型)
T1D的体内模型可以是遗传的,也可以是化学诱导的。
非肥胖糖尿病(NOD)模型是最常用的T1D自发模型,其主要优点是产生自发的自身免疫和与人类疾病高度相关的T1D。其他自发的T1D模型包括BB大鼠和免疫缺陷的NRG-Akita小鼠。
T1D的化学诱导模型依赖于胰腺β细胞的化学消融来诱发疾病,四氧嘧啶或链脲佐菌素(STZ)是最常用的用于β细胞消融的药物。化学诱导模型的建立相对简单和便宜,它们通常用于评估其主要机制是降低血糖的治疗中的作用(独立于β细胞)。
MS-NASH的临床前模型
与其他传统模型相比,MS-NASH模型(原名FATZO)是一个更具有平移性的模型,因为它更好地概括了复杂的人类疾病。该模型是通过给予西方饮食加果糖诱导NAFLD/NASH产生的。在节食的时候,模型发生脂肪变性(4-8周),肝细胞膨胀(16周),炎症(16周),随着时间的推移发生NASH和纤维化(20周),表现为糖尿病前期状态的肥胖,并缓慢发展为显性糖尿病。NASH病理的恶化和进展随着CCl4的使用而加速。
系统性红斑狼疮临床前模型
与人类疾病密切相似的自发性SLE模型可以帮助药物通过临床前体内试验取得研究进展。两种自发的临床前模型具有不同的机制,已表现出可以捕捉许多关键的临床和病理SLE特征。这些模型包括:
- MRL/Faslpr: SLE通常在9-10周发病,并持续发展7-9周。主要表型包括显著的淋巴增生和淋巴结病、肾小球肾炎和蛋白尿、皮肤病变和CD3+CD4-CD8- T细胞的扩增。
- NZB/W: SLE发病于22-23周龄,并持续发展12-13周。主要表型包括显著的脾肿大,肾小球肾炎和蛋白尿,以及长期存在的自体反应浆细胞。
结论
尽管与IMIDs相关的机制具有生物复杂性,但近期的IMIDs研究已经取得了重大进展;鉴于我们对IMID发病机制探究的深入,这一趋势有望继续下去。
然而,IMIDs研究中仍然存在许多挑战,包括如何有效地用免疫肿瘤疗法治疗IMID癌症患者,以及如何更好地针对最有可能受益的患者进行IMID治疗。
新的和传统的体内模型继续为临床前IMID药物开发研究提供资料,但选择正确的模型并不总是轻而易举的,需要仔细考虑研究目标和模型的优缺点。
请继续关注关于IMID的一系列博客,并查看我们以前的博客、白皮书和网络研讨会,以获得更多关于我们支持IMID药物开发的专业知识的信息。
如果您正在寻找为您的研究选择正确的临床前模型的指导,我们在这里提供帮助。 请在这里填写表格,与我们的科学专家交谈或了解更多关于我们的IMID体内模型 www.crownbio.com/in-vivo-inflammation-autoimmune-models
请继续关注关于IMID的一系列博客,并查看我们以前的博客、白皮书和网络研讨会,以获得更多关于我们支持IMID药物开发的专业知识的信息。