药物开发是一项漫长、高风险和耗资颇大的活动,会筛除大量候选药物。相较于其他类型的治疗药物,候选抗癌药物具有更高的筛除率。预计仅5%的候选抗癌药物可以进入临床研究阶段。筛除率非常高,这部分归因于当前临床前数据较差的可转化性。
在本文中,我们考察了通过 3D 体外类器官提高的抗癌新药发现的可预测性,如何更准确地模拟复杂的体内环境(相较于传统 2D 单层培养系统)。类器官的使用实现了“在培养皿中进行临床试验”的目标,进而改善了抗癌新药发现程序并提高了新药发现速度。
癌症是高异质性疾病
癌症的病因复杂;肿瘤细胞不断突变。此外,
癌症较高的异质性进一步增大了研究复杂性。癌症不仅在患有同类癌症的不同患者之间存在巨大差异(肿瘤间异质性),即便同一患者身上的癌症也有所不同(肿瘤内异质性)。该异质性不但增大了识别最适宜药物靶点的难度,而且延长了药物发现过程。它被视为临床应用中症状无缓解和产生耐药性的重要原因。
为了开发有效的候选药物,人们需要深入了解与患者相关的临床前预测性模型中的肿瘤异质性,因为该模型可反映癌症在细胞和人群层面的多样性。目前,与患者相关的肿瘤类器官已被用于克服其他体外培养系统可转化性较差的缺陷。这些肿瘤类器官具有更高的可转化性和可预测性,适于进行高通量筛选(HTS)。
3D 体外类器官
类器官是一种镜下自组织结构,具有原始体内组织的复杂结构性和功能性特性。有一套基于Hans Clever 原创文章的经优化Hubrecht Organoid Technology(HUB)方案,可用于通过正常和患病组织(包括肿瘤组织)制作模型(参见此处,查看 HUB 肿瘤类器官方面的深入讨论)。
无需使用成人器官特异性干细胞,研究人员仅通过HUB方法就可以用含上皮细胞的任意组织(例如肝脏、肠、肺、甲状腺、胃和肾脏)培养类器官。HUB类器官不需要重新编程或转化细胞。该特性有助于保留组织的原始基因表达方式和表观遗传组成,这包括提供疾病发病机制相关重要信息的相关突变。此外,通过优化用不同组织制作类器官模型的方案,不仅可以简化制作过程,还可以大幅提高可靠性和重现性。
通过细胞外基质信号制作 HUB 类器官,模拟母体组织的局部环境,准确模拟体内微环境。可以通过患者来源类器官(PDO)直接制作,也可以通过在大鼠体内扩展的患者组织(作为患者来源异种移植类器官,即 PDXO)制作模型。这是两种处理患者原代细胞的备选方法。它们均可以被用作患者的替代项,因为它们准确模拟了亲代肿瘤的基因组、形态学和病理生理学特征。此外,相较于体内模型,人们可以更轻松地缩放肿瘤类器官。即使在长期培养和冻存之后,肿瘤类器官仍具有基因和表型稳定性。
2019年,冠科生物与 HUB 建立了战略性合作伙伴关系,成为 HUB 临床前抗肿瘤药物开发和验证技术的独家供应商。
适应症库
该合作伙伴关系促成了多样型肿瘤类器官库 OrganoidBaseTM的建立。研究人员可以访问各类癌症(包括乳腺癌、结直肠癌和胰腺癌)的患者相关PDXO肿瘤模型可搜索云数据库。这些模型提供了组织病理学、IC50、基因组和转录组分析相关数据。
每个肿瘤模型的 OrganoidBase 均包含来自同一患者的患病和相匹配健康类器官。这些成对类器官成为有效的新药发现平台,因为它们可以协助研究人员发现疾病相关靶点,筛选先导化合物,分析药物反应和更早预测治疗结果。大量且经良好表征的肿瘤类器官生物样本库可通过可转化性更高的体外数据,提高先导化合物的患者相关性。
用于发现抗肿瘤新药的肿瘤类器官
可以在多孔培养板中培养肿瘤类器官,以便同时对多种药物进行 HTS 和分析。该方法还可以验证候选先导药物在类器官模型中的有效性和毒性,例如来自相匹配健康组织和/或不同遗传背景的类器官模型。
此外,大型健康和肿瘤类器官生物样本库,可被用于对大型研究中发现的患者人群多样性进行建模。该生物样本库协助研究人员在实验室内开展临床试验,以便确定反应的预测性生物标记物(基于基因组分析),测试联合用药策略(例如多剂量比、组合效应)和用健康对照来评估治疗时间窗。
例如,冠科生物的科学家用三个p53 突变体类器官模型(从 OrganoidBase 中选择)研究2种细胞周期检查点抑制剂(WEE1 抑制剂 MK-1775 和 CHK 抑制剂 MK-8776)及其与吉西他滨(化疗制剂)联用的作用。测定细胞活力时,我们发现,2种检查点抑制剂(低浓度)在胰腺癌类器官模型中具有较强协同作用。此外,我们还惊奇地发现:吉西他滨与1种检查点抑制剂的药物协同作用在抑制肿瘤细胞生长方面具有较高效率。
3D 类器官与高内涵成像(HCI)技术的配合使用
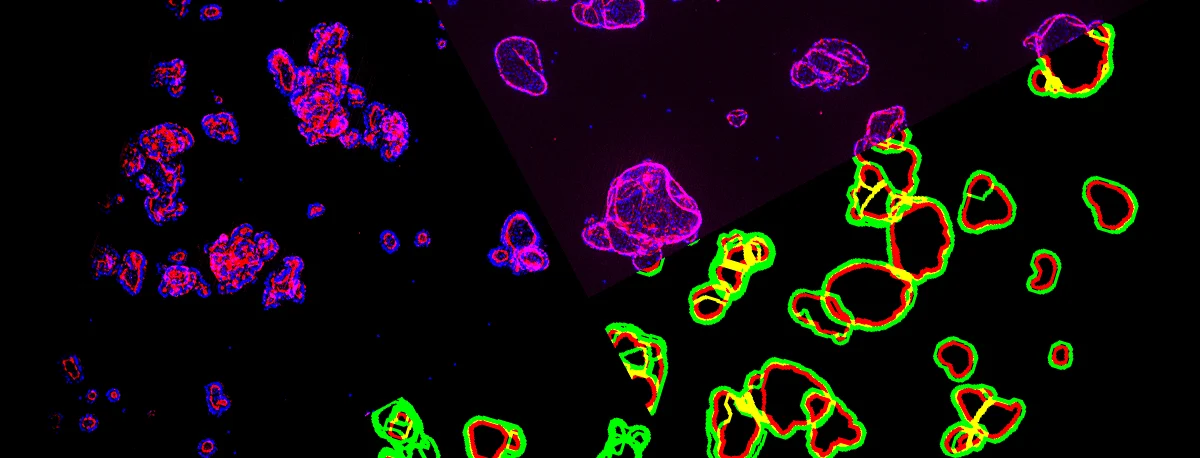
HCI 和分析(HCA)平台使得研究人员可以捕获和分析类器官活力和表现型方面的细微变化。如既往文章中所述,HCI 总体上是一种基于自动成像的高通量技术。HCA 提供了应用于 HCI 数据的多参数算法。患者相关 3D 体外肿瘤类器官与创新性 HCI 和 HCA 的配合使用,可以为复杂的细胞系统生成极其详细的细胞生理学特征,这包括类器官和共培养物的多细胞结构,例如在免疫治疗效果研究中将肿瘤类器官与免疫细胞一起培养(图1)。此类配合使用非常有效,可以获得用于定义先导候选药物对于肿瘤类器官生长所产生影响的预测性和可转化临床前数据。
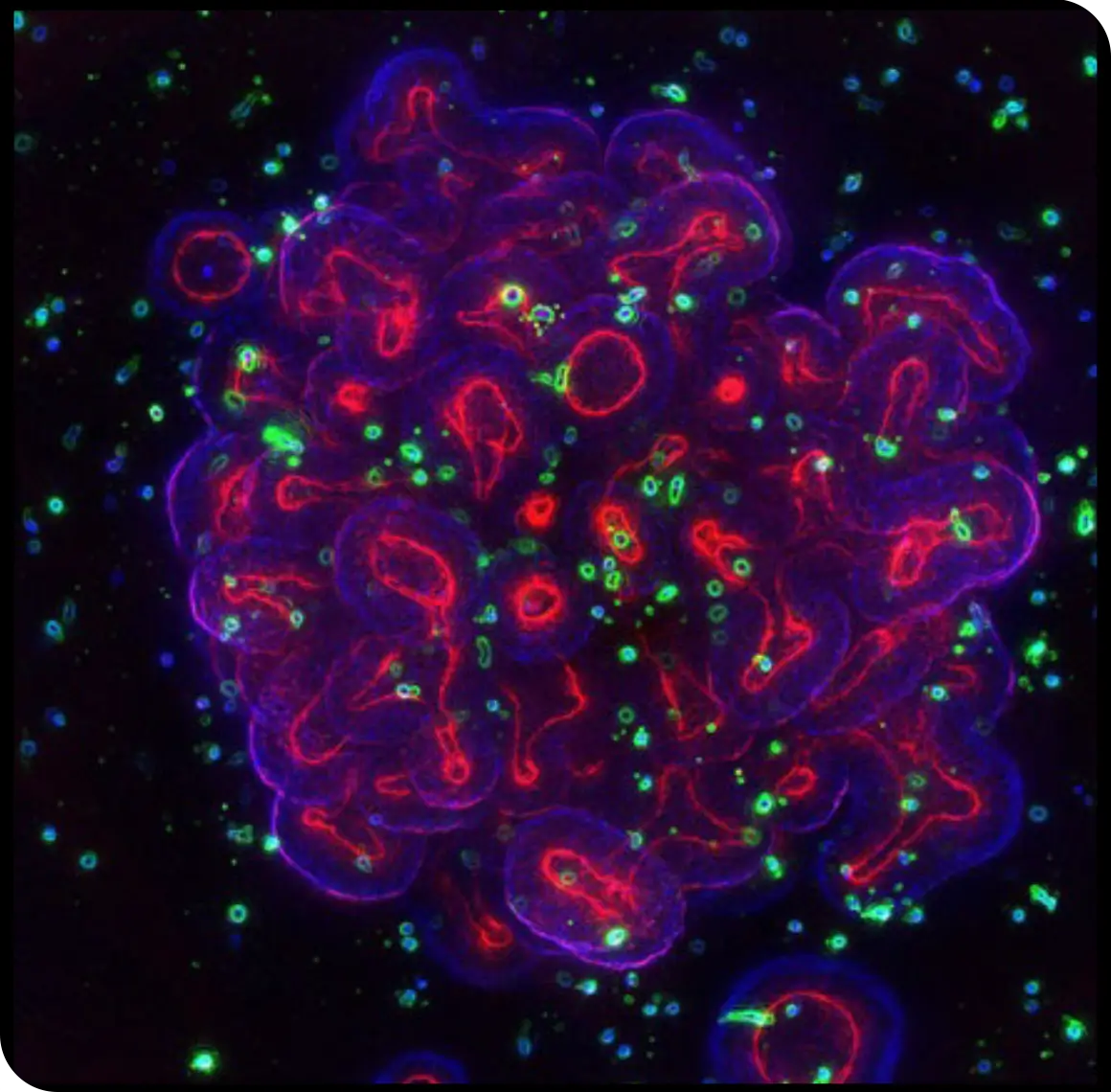
图1:免疫肿瘤学研究获得一个新工具。3D 类器官(紫色和红色)与免疫细胞(绿色)的共同培养
测试体内药物活性
目前,市场上供应了超过 3,000 款用于超过30类癌症(包括乳腺癌、结肠直肠癌、胃癌、前列腺癌、卵巢癌、肺癌、肾癌和脑癌)的临床相关患者来源异种移植(PDX)小鼠模型。这些模型反映了人群的异质性和多样性,并提供了有高特异性分子靶点之疾病的相关观点。
通过体外类器官模型确定潜在药物靶点之后,研究人员可以用 PDX 模型来评估全身作用。体外模型和相匹配体内模型的配合使用不一定适用于原代细胞。这表明,肿瘤类器官在药物发现方面具有另一项显著优势。可以辅助使用体内相匹配模型,从而可以从早期体外研究转变为后期基于动物的验证试验。
肿瘤类器官可以是 PDO 或 PDXO。然而,PDXO 可以扩大人群研究中的 PDO 收集范围(通过用现有 PDX 生成新模型),并协助通过独特的相匹配模型从体外研究转变为体内研究。此外,还可以用现有PDO制作新体内 PDX 模型,将其作为生成新匹配对的备用方法,这与用于制作 PDX 模型的经设计类器官尤其相关。
作为联合使用 3D 体外类器官和相匹配 PDX 模型的示例,Verissimo 等人制作了一组含野生型或突变型RAS的结肠直肠肿瘤类器官,以及正常类器官和含 CRISPR 所引入致癌 KRAS 突变体的肿瘤类器官。他们评估了 RAS 通路抑制剂,包括为对抗 RAS 突变癌症而临床测试的联用药物。整体上,突变体 RAS 与对于这些药物治疗的耐药性密切相关。此外,还通过异种移植的 RAS 突变体类器官评估体内药物反应,并确认体外结果。
结论
抗癌新药发现方法成本高、风险大、速度慢、效率低。然而,通过 3D 体外类器官可以提高抗癌新药发现的可预测性,进而改变这一局面。
相较于 HTS 中常用的传统 2D 细胞培养系统,3D 肿瘤类器官与患者具有更高的相关性。此外,相较于体内 PDX 模型,3D 肿瘤类器官更易于缩放。3D 体外肿瘤模型准确地模拟了原始肿瘤的基因组学、形态学和病理生理学特征。即使在长期培养和冻存之后,肿瘤类器官仍具有基因和表型稳定性。
根据特定需求,您可以根据按照独有 HUB 方案制作的临床相关肿瘤类器官,用简化版肿瘤类器官筛选包快速获得结果。
了解冠科生物通过根据IP保护型 Hubrecht Organoid Technology(HUB)方案制作的独特类器官模型以及现有患者来源类器官(PDO)的 HUB 生物库所提供之临床前抗肿瘤药物开发和验证服务方面的更多信息。