对您的药物进行可视化并超越其细胞活力
在本文中,我们探讨了如何将高内涵筛选(HCS)与3D体外模型结合使用,以推动新型肿瘤学疗法和免疫肿瘤学疗法的发现和开发。
高内涵筛选是什么?
正如我们在前一篇文章中所述,HCS是一种用于收集详细量化数据的工具,数据来源涵盖从简单到复杂的细胞系,例如3D球状体、类器官甚至是共培养系统。
高通量筛选(HTS)通常提供单终点生化读数。相比之下,HCS能够使用基于荧光的多色图像,以亚细胞分辨率进行高通量表型分析。
这种多参数方法对新型先导化合物的特异性和灵敏度提供了更深入的了解,从而在将资源投入到劳动密集型和成本高昂的下游体内研究之前,指导做出Go/No-go决策。
成功实施HCS,需要将高内涵成像(HCI)和高内涵分析工具(HCA)相结合,例如多参数图像处理和可视化工具。
将这些先进的工具、软件、试剂和生物信息学途径结合起来,这意味着可以快速生成大量有价值的数据,以提供有关细胞和药物相互作用的极为详细的视图。
这些成就导致HCS越来越多地被应用于肿瘤学研究以及许多其他学科,其应用范围涵盖了从命中鉴定到先导优化的药物发现途径。
利用3D细胞培养模型的效能
虽然HCI系统和分析软件已问世约20年,但其主要用于分析单细胞厚层。然而,随着对细胞异质性和微环境如何影响疾病过程的理解日益加深,人们不断努力为更具可转化性的3D体外模型开发HCI方案。
类器官和球状体代表两种最常见的3D细胞培养类型。
类器官是体外药物筛选的创新性进步。优化后的Hubrecht Organoid Technology(HUB)方案,如今可以从健康组织和患病组织(例如肿瘤)中重复生成3D体外类器官。
其易于扩展且具有高度临床相关性,对患者出现药物反应的预测性比2D细胞培养物中的更高。与其他先进的培养系统相比,3D体外类器官:
- 更可靠
- 显示重现性增强
- 基因和表型极为稳定(即使经过长期培养和冻存)
- 批间变异性较小
此外,其生长动力学和性能在多次传代中具有一致性,即具有可用于重复研究的可扩展材料。
这些特征导致高质量数据具有可重复性,而这正是最大限度地选择具有更佳可转化性和临床成功的候选药物之关键所在。
此外,类器官适用于所有正常的实验室技术,从传统基因工程到更先进的基因编辑方法。总之,HUB类器官使研究人员能够在早期药物发现时做出更好的决策,并增强对所选候选药物具有更佳可转化性的信心。
与标准2D单层培养物相比,球状体还可以更好地再现体内细胞环境。然而,与源自来源组织内干细胞群的类器官不同,球状体是通过聚集形成的。
这导致在结构中,结构和生理器官相关性较低。该缺点使其无法进行长时间培养。但球状体则易于使用。
当源于肿瘤组织时,其会导致“肿瘤球”富含具有癌症干细胞(CSC)特征的细胞。这使得球状体成为评估该细胞群的治疗靶向特征(例如耐药性)的良好模型。
使用HCS、HCI和HCA方法的类器官应用
高内涵成像和分析
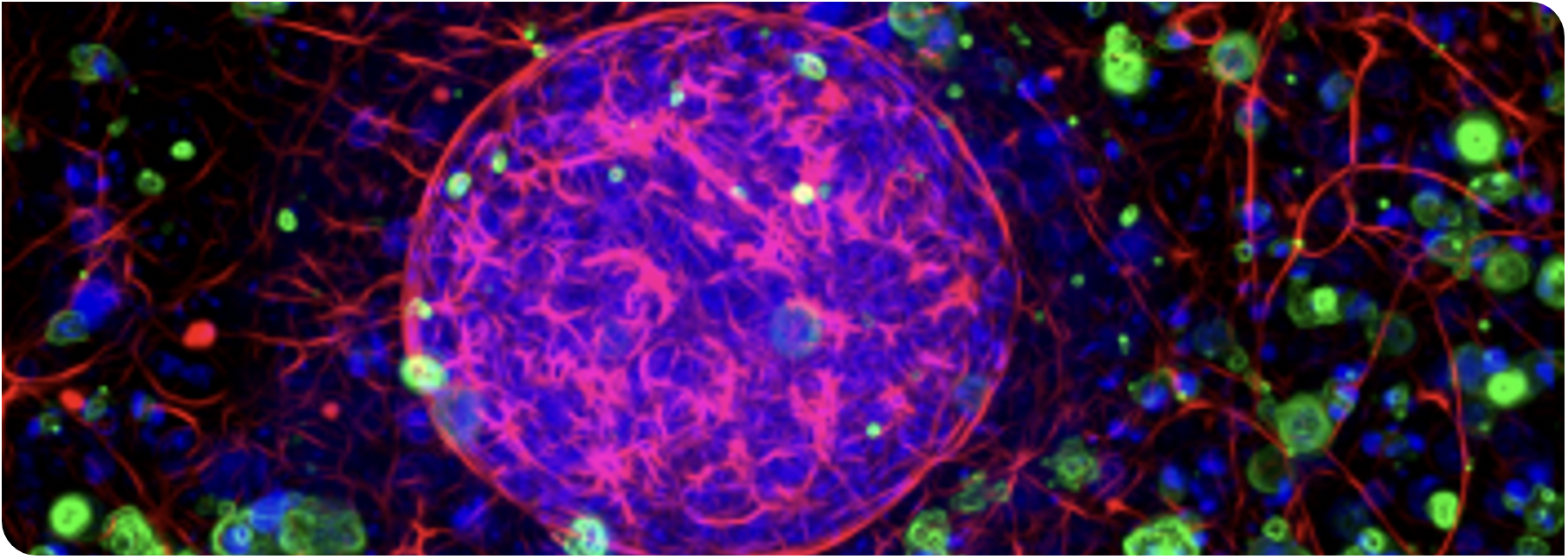
HCI使空间分析能够利用3D体外模型,提供更多生物学优势和生理学信息内容。为了进行准确的基于图像的分析,需要能够从单个类器官中提取数据的高级图像处理算法。在优化上述条件后,就可以测量试验药物对类器官大小和形状等参数的影响。

图1:具有代表性的HCA图像表明,从原始多色荧光图像中准确分割单个3D类器官和细胞层。
HCl还可用于区分诱导细胞周期阻滞、凋亡和坏死的化合物。与标准生化活力测定法(例如CellTiter-Glo(CTG))相比,这是一项重要优势。使用HCI有无限可能。可用测定使研究人员能够评估各种读数,包括肿瘤细胞杀伤、靶标表达、抗体结合和其他形态参数(例如浸润和分化)。
最先进的HCI服务和可靠的3D体外成像分析如今可用。当与人源异种移植类器官肿瘤模型的具有良好注释的生物样本库、人源类器官以及来自CDX和人源异种移植材料的3D球状体相结合时,研究人员现在拥有大量的模型,其可以提供最佳机会来鉴定和优化具有最高临床潜力的先导化合物。
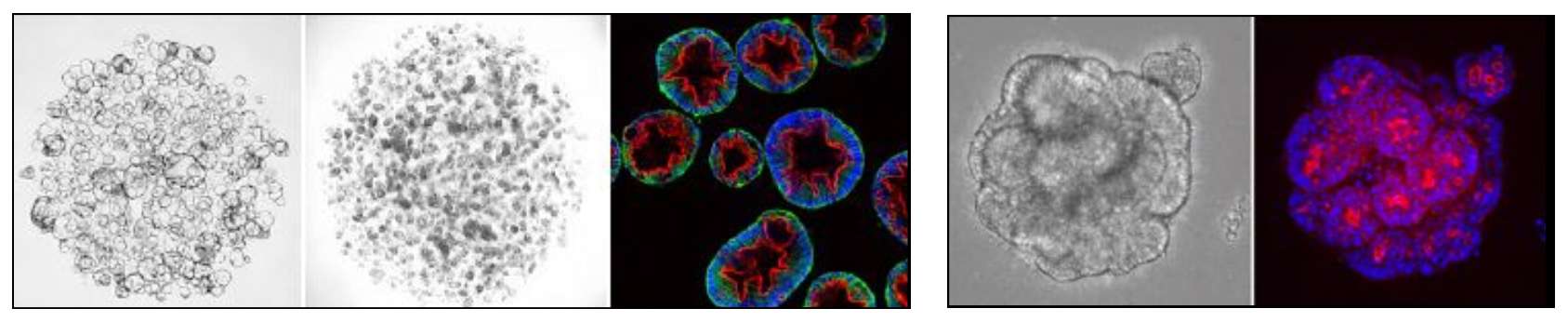
图2:3D人源类器官(左)和人源异种移植类器官(右)的代表性HCA图像。
HCI平台能够以可扩展的384孔格式对治疗反应进行表型评估,并同时测试单一或多种药物组合策略。借助先进的3D图像分析软件,可以准确监控由新药引起的500多种表型变化,并用于指导候选治疗方案的Go/No-go决策。
基于HCI的高通量药物筛选
HCI的优势还在于可以对3D体外模型进行大规模肿瘤药物筛选。基于HCI的HTS筛选可以测试单一药物、化合物库、剂量范围和药物组合。
其与各种常见和新型药物类别兼容,包括:
- 小分子
- 肽和蛋白质
- 抗体
- 双特异性
- 抗体偶联药物
- 溶瘤病毒
- 细胞疗法

图3:基于图像的类器官高通量药物筛选综述。
可以测量的治疗反应包括活性、毒性和协同作用,以及类器官生长/杀伤的快速读数(与CTG相当)。还可以评估作用方式和脱靶效应,以更全面地了解研究药物。

图4:来自人源类器官的HCA图像显示了存在Ras和PI3K突变时与变异相关的各种类器官形态。
基于图像的HTS在类器官中的工作流程
典型的HTS类器官筛选工作流程包括进行三次一般细胞活力测定(CTG)的初始质量控制(QC)步骤。这种快速QC可用于在开始全面筛选前检测3D培养条件的任何问题。

接下来,将通过细胞接种和加入化合物开始筛选。在所需的时间点,获取并分析每个对象的荧光核和肌动蛋白信号的3D图像,以鉴定细胞和类器官边界(分割)。QC步骤验证图像质量。
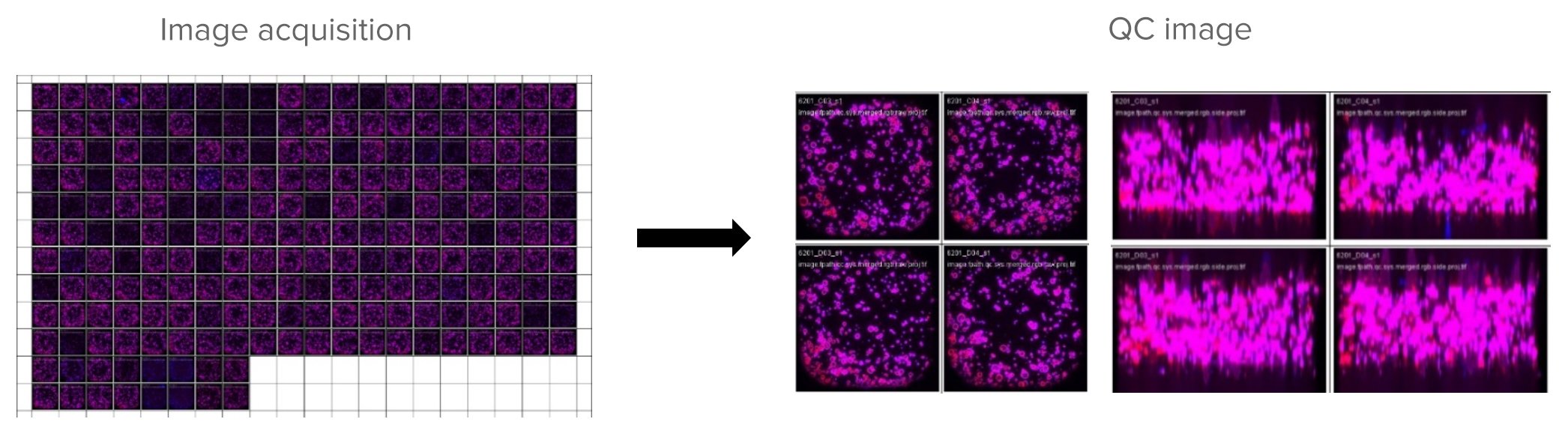
然后,3D图像分析由内部技术强大的软件包执行,该软件包可以从各重组图像中提取多变量数据。

接着分析该丰富的数据集,并通过一套可视化工具(可以被进一步挖掘以达到选择要求)运行表现性读取结果。

基于HCI的免疫肿瘤学分析
免疫肿瘤学的成功是 癌症治疗的一个里程碑,在新型免疫肿瘤学研究药物方面引发了一波浪潮。
使用3D体外细胞培养系统,尤其是肿瘤免疫细胞共培养系统,正在成为一种评估免疫肿瘤学药物的重要方法。这些复杂分析旨在:
- 模拟肿瘤免疫微环境
- 确定测试化合物的免疫调节特性
- 剖析免疫细胞群和肿瘤细胞群之间复杂的相互作用

图5:用于评估免疫疗法的3D肿瘤模型。
与HCI平台相结合的免疫肿瘤学分析可用于评估一系列免疫疗法,包括检查点抑制剂、疫苗、溶瘤病毒、细胞疗法和双特异性T细胞衔接器。
读数包括免疫细胞启动、主动迁移、肿瘤浸润和肿瘤细胞杀伤。HCI分析也可用于监控免疫疗法对髓样细胞的影响,髓样细胞是促进进展性肿瘤的关键免疫细胞群,也是下一代免疫疗法的拟定靶点。

图6:基于HCI的免疫肿瘤学分析概述。
上图:类器官包埋在384微孔板的细胞外基质中。对免疫细胞进行染色并将其加入至水凝胶上。在免疫成分之前或之后,同时加入测试化合物。将共培养保持1-7天。在固定/染色之前收集上清液。“光学切片”后,重建3D图像堆栈。执行图像分析以读出药物效果。
下图:图像处理旨在提取单个类器官对象和单个免疫细胞对象,并测量类器官表型(形状、大小)、免疫细胞计数和类器官内的相对位置。
结论
3D体外细胞培养模型,能更准确地反映肿瘤微环境,现已广泛应用于药物发现和开发。
当这些与高内涵图像分析结合使用时,先导化合物鉴别和优化可以超越标准生化读数,直至基于表型的变化,所有这些都在一个更具生理学相关性的系统中进行。
欲了解有关基于图像的高内涵分析是如何支持您的药物发现工作的更多详细信息,请咨询我们的专家。