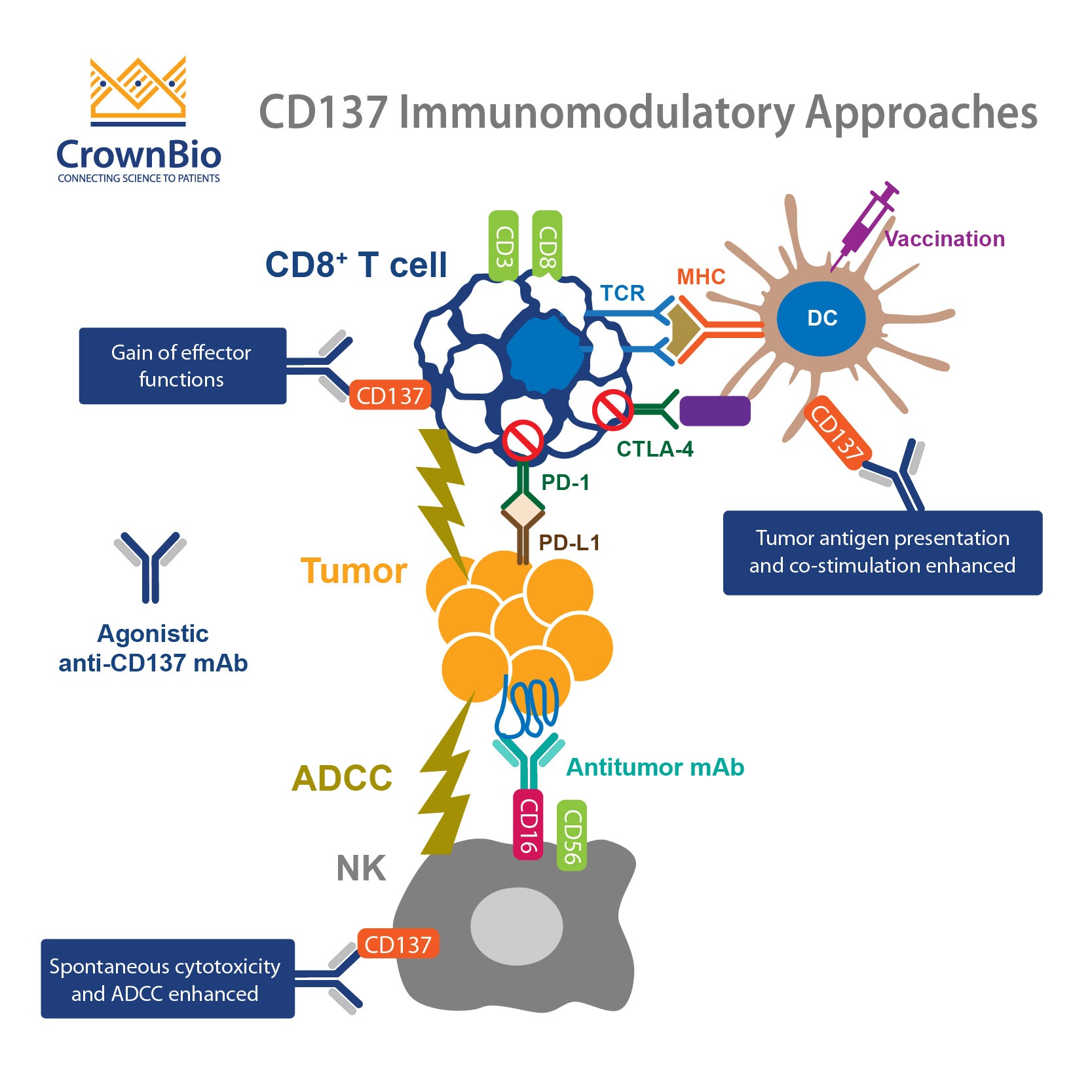
根据 OX40的文章,我们的肿瘤坏死因子超家族研究将延伸探讨至CD137,T细胞共同刺激的另外一个重要的标靶。
CD137刺激免疫系统来对抗癌细胞
相较检查点抑制剂使用的模式 (阻挡配体/受体互动),肿瘤免疫的研究中还有免疫调节标靶:共同刺激标靶。
对于富有产生力的 T细胞来说,细胞必须能够透过抗原与同源T细胞受体来辨认自己的标靶,同时T细胞必须接收到共同刺激信号才行。这些信号是透过共同刺激配体与受体而产生,像是CD137与他的配体—CD137L
引此,当检查点抑制剂的目的是阻挡癌细胞用来躲避免疫系统的抑制信号,共同刺激标靶药物机制则被设计用来刺激免疫系统,对抗癌细胞。
CD137可以做为T细胞活化的替代指针
CD137(TNFSFR9)原本被认为是一种分子促成的活性老鼠或人类CD4+与CD8+T细胞,并在不被发现的情况由非活性T细胞来表达。他也能透过自然杀手细胞与树突细胞中找到。受体结合后会造成T细胞增殖与产生IL-2以及细胞凋亡。
做为 CD137抗原的强力支持,T细胞可以透过血液来表达CD137,也能够用来展现抗源的特异性,包含肿瘤抗源(1,2)。因此CD137可以做为活化T细胞的替代指针。
细胞表达 CD137强大的作用细胞
CD137对抗源活性作用T细胞还有许多的重要性,例如利用CD137来选择要消耗的T细胞,有效的控制GVHD的同种异体 T细胞。
将这些观察整合后,证实了 CD137是一种强大的作用细胞,例如那些需要免疫控制癌症以及自身免疫性疾病里不被需要的。若是前者发生,CD137是一种适合肿瘤免疫研究选项。
CD137激动剂临床实验与综合疗法
上述讨论证实了 CD137激动剂抗体的使用方法并再许多地方都有详细的解说(4-6)。目前有两种抗体症正在进行临床实验:
有趣的是,有许多的案例指出urelumab造成了负面的影响,包含了肝中毒与疲劳。而utomilumab则没有证据指出剂量限制毒性(5,7)。Urelumab的肝中毒通常是在使用了抗CD137抗体(8)的老鼠模型中。
缺乏理解不同负面影响之情况
目前还无法完全理解为什么urelumab和utomilumab会有不同,但就观察来说,临床实验与负面影响的发现息息相关。例如Urelumab在效果方面是否比utomilumab好上许多,研究员还是无法捉摸清楚。
许多 CD137激动剂与检查点抑制剂的联合疗法在临床研究中表现有如预期,请持续关注ClinicalTrials.gov来获得更多信息。
更多 CD137 的使用:嵌合抗原受体重组 T 细胞疗法 (CAR-T Therapy)
CD137有其他的方式用来做为标靶。抗CD137被用来测试TIL回输用的临床体外刺激物,也被用来促使T细胞耗竭的发生(9)。CAR-T疗法目前也正在寻找如何与CD137在第二与第三世代的药剂结合(10)。
当我们正在观察urelumab与utomilumab的临床实验发展,不管是做为个别药剂还是许多联合实验中使用,我们很期待未来CD137 能够发展到何种程度。
参考文章
- Ye at al. CD137 accurately identifies and enriches for naturally occurring tumor-reactive T cells in tumor. Clin Cancer Res 2014;20(1):44-45.
- Wolfl et al. Activation-induced expression of CD137 permits detection, isolation, and expansion of the full repertoire of CD8+ T cells responding to antigen without requiring knowledge of epitope specificities. Blood 2007;110(1): 201-210.
- Lee et al. Depletion of alloreactive T-cells by anti-CD137-saporin immunotoxin. Cell Transplant 2015;24(6): 1167-1181.
- Yonezawa et al. Boosting cancer immunotherapy with anti-CD137 antibody therapy. Clin Cancer Res 2015;21(14): 3113-3120.
- Chester et al. 4-1BB agonism: adding the accelerator to cancer immunotherapy. Cancer Immunol Immunother 2016;65(10): 1243-1248.
- Sanchez-Paulete et al. Deciphering CD137 (4-1BB) signaling in T-cell costimulation for translation into successful cancer immunotherapy. Eur J Immunol 2016;46(3): 513-522.
- Segal et al. Results from an integrated safety analysis of urelumab, an agonist anti-CD137 monoclonal antibody. Clin Cancer Res 2017;23(8): 1929-1936.
- Dubrot et al. Treatment with anti-CD137 mAbs causes intense accumulations of liver T cells without selective antitumor immunotherapeutic effects in this organ. Cancer Immunol Immunother 2010;59(8): 1223-1233.
- Long et al. 4-1BB costimulation ameliorates T cell exhaustion induced by tonic signaling of chimeric antigen receptors. Nat Med 2015;21(6): 581-590.
- Smith et al. Chimeric antigen receptor (CAR) T cell therapy for malignant cancers: Summary and perspective. Journal of Cellular Immunotherapy 2016;2(2): 59-68.