探索为何成体干细胞(ASC)衍生的HUB技术能够成为肿瘤药物发现唯一可用的肿瘤类器官平台。
类器官的来源
类器官源于不同类型干细胞,如多能干细胞(PSC)或多能器官特异性成体干细胞(ASC)等。起始点选择不同引起了类器官及其应用之间的关键差别,这在肿瘤研究和药物研发方面表现得尤为突出。
PSC源性类器官与ASC源性类器官开发之间的主要差异
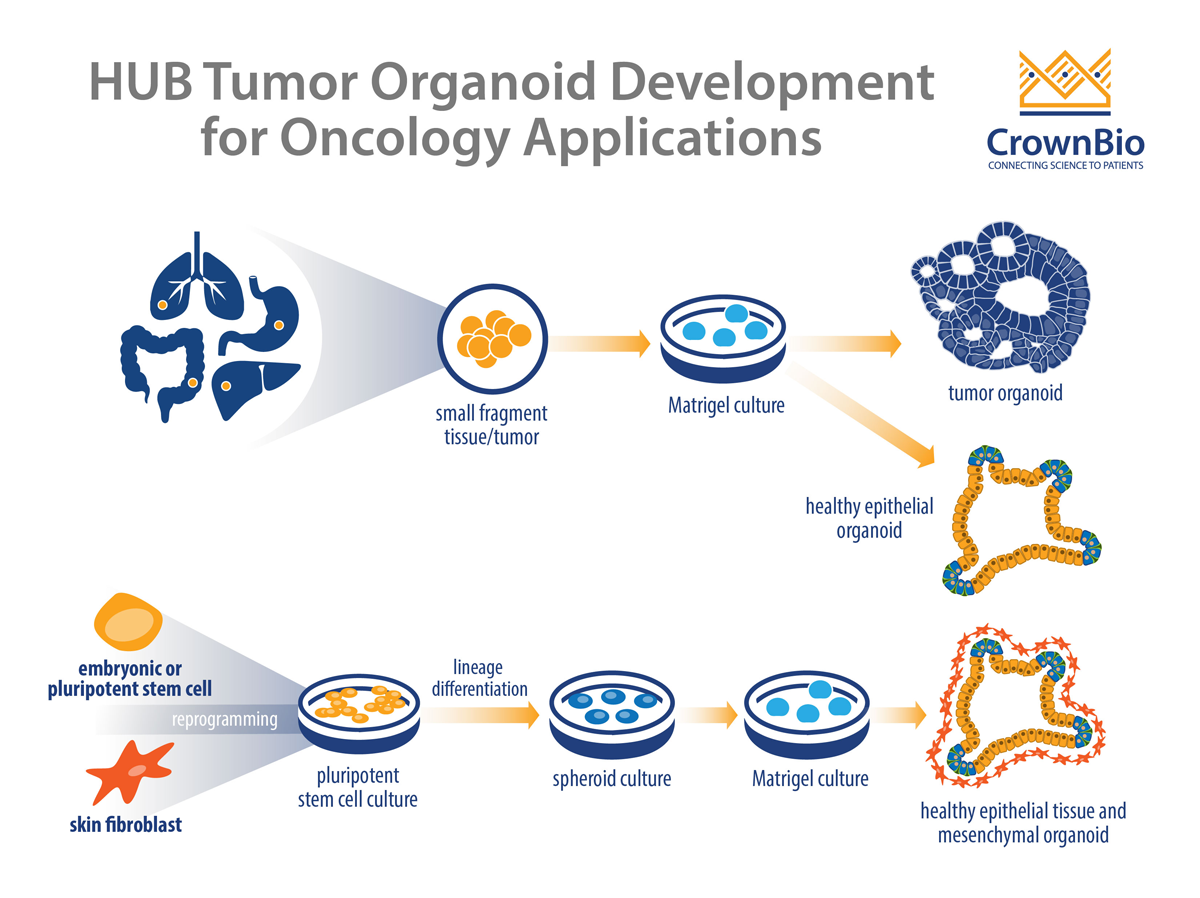
PSC源性类器官通常从胚胎干细胞或诱导PSC(iPSC)获取。iPSC生成类器官是一个多步骤的过程,需要根据相关组织(内胚层、中胚层或外胚层)将干细胞重编程并再分化成适当的谱系。另外,该过程还需要一个引导PSC分化成所需细胞的影响因素与间充质细胞巢的特定组合,以及一个在发育成类器官前通过球样培养基的通道。iPSC被广泛用于衍生大脑类器官,从而开展器官开发和病理学研究。
相反,ASC源性类器官是由组织特异性干细胞群发育而来。ASC是在无间充质细胞巢的情况下生长的。ASC的发育受到生长因子的支持,后者的存在确保了ASC自我更新并分化成亲本器官中各类下游细胞。这种ASC流程因Clevers实验室的一系列重大发现而成为可能,该实验室发现小肠中有ASC。他们也是在培养皿中培养出迷你内脏的第一家研究单位。后续研究表明,ASC存在于其他上皮源器官中,如胃、肝脏和胰腺。
Hubrecht Organoid Technology (HUB)对该技术进行了拓展和优化,并同时利用健康组织和患病组织开发出三维类器官,包括肿瘤类器官。HUB技术开发了稳健的可再生类器官模型,可连续数代保留原始器官遗传学和基因表达特征。这是一种更快的类器官开发方法,因为ASC无需重编程来分化成适当的谱系。另外,由于没有间充质细胞巢,推动了更稳健模型的构建,因为间充质细胞会随着时间推移影响培养物的稳定性。
HUB技术是唯一的肿瘤类器官平台
ASC源性与iPSC源性类器官之间最重要的区别在于它们在肿瘤研究中的应用。
与iPSC源性类器官不同,ASC源性类器官有两个来源:健康组织肿瘤患者组织。现已利用HUB完善的方案及相关培养基开发了各类肿瘤的肿瘤类器官。这些类器官是使用肿瘤患者材料开发的,用于建立肿瘤(和匹配的健康)类器官的生物样本库,据此获取肿瘤患者人群中的表型和遗传异质性。
PSC可通过基因工程诱导致癌或抑癌基因突变。这种基因突变会引起瘤样生长,但是这些模型不具有各种临床肿瘤的遗传组分复杂性,后者只能从一开始就模拟患者材料才能获得。
正因如此,所以说HUB技术开发的肿瘤类器官是肿瘤(特别是上皮瘤)药物研发唯一可用的临床相关类器官模型。
使用HUB肿瘤类器官进行肿瘤药物研发
庞大的活体生物样本库的开发(利用HUB方案开发的肿瘤类器官),实现了“将患者带入实验室”。这些肿瘤类器官用于针对大规模人群开展研究,调查治疗反应并鉴别生物标志物。该方法相当于临床试验,只是它是在培养皿中进行的,因此可以加快药物研发速度并降低肿瘤候选药物的高失败率。
结论
尽管可使用不同类型干细胞建立类器官,但是HUB技术是实体上皮癌药物研发的唯一可用平台。HUB 技术开发的肿瘤类器官具有高度患者相关性,可用于开发生物样本库,从而使“培养皿内的临床实验”成为可能。