全球每一年有将近 140,000 人 (光美国就有15,000人) 被整诊断出表皮生长因子 (EGFR) 阳性的非小细胞肺癌。 EGFR阳性的癌症因为基因的改变,造成了EGFR蛋白质过量,也促使癌细胞的成长。
不同的突变有不同的治疗方法,而这篇文章将探讨较普遍的、有抗性的、典型的突变。
药物标靶 EGFR 突变会造成非小细胞肺癌恶化
EGFR 突变通常都是在非小细胞肺癌的病例中发现 (大约15%的案例来自于非小细胞肺癌) 。 EGFR基因改变的范围包括了:
- 典型的 exon 19 in-frame deletion (45%)
- E xon 21 L858R (40%)
- E xon 20 T790M “gatekeeper” 突变
- 非典型 exon 18 G719X (3%) 与 exon 20 insertions (5–10%)1.
以上皆是 EGFR 的基因改变对于药物靶向非小细胞肺癌的重要性。
酪胺酸激酶抑制剂能够有效治疗典型 EGFR 突变病患
典型 EGFR 突变的非小细胞肺癌病患通常对特定的 EGFR 酪胺酸激酶抑制剂有极高的反应。 EGFR标靶治疗距离初次登场已经有将近15年的历史,帮助了无数的病患延长他们的生命。
第一代的 EGFR 酪胺酸激酶抑制剂「吉非替尼」、「厄洛替尼」、「埃克替尼」的设计是为了反向融合三磷酸腺苷,来阻挡 EGFR 造成的下游信号,抑制不受控制和突变的 EGFR 。
尽管如此,第一代的酪胺酸激酶抑制剂更适合用来结合突变的 EGFR ,确保反应够强。
酪胺酸激酶抑制剂产生的抗性降低了生存率
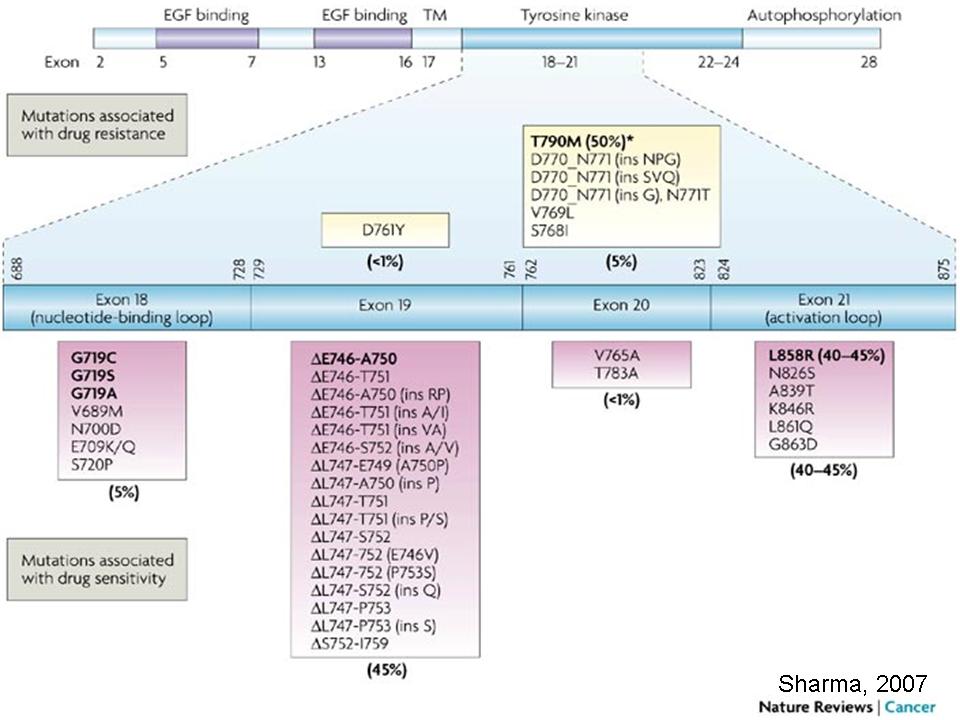 EGFR Mutations in Lung Cancer and Their Effect on Drug Response
EGFR Mutations in Lung Cancer and Their Effect on Drug Response
From Sharma et al. Nat Rev Cancer 2007;7(3): 169-181.
第一代的酪胺酸激酶抑制剂常使用在非小细胞肺癌的 EGFR 突变。
比起化疗用来做为第一线治疗非小细胞肺癌的 EGFR 突变,第一代 EGFR 酪胺酸激酶抑制剂明显的增加了响应率 (response rate, RR)以及无恶化存活时间 (progression-free survival, PFS) 。
但是,整体生存率 (overall survival, OS) 并没有因为病患的 EGFR T790M 抗性突变而提升。
更强大的第二代 EGFR 酪胺酸激酶抑制剂
相较于初代,第二代或第三代的 EGFR 酪胺酸脢抑制剂有更强大的抑制能力,能够克服 EGFR T790M 。
第二代 EGFR 酪胺酸激酶抑制剂是一种无法反转的抑制剂并能与 EGFR 激酶主体融合,也能够抑制其他 EGFR 家族的成员。
第三代 EGFR 酪胺酸激酶抑制剂克服了 T790M 突变的「守门员」 (Gatekeeper) ,但抗性依然存在
第三代酪胺酸激酶抑制剂对于 EGFR 突变与 T790 抗性突变有很好的效果,对于不受控制的 EGFR 则是有限的效果。
尽管这个最终世代的酪胺酸激酶抑制剂有着不错的前景,抗性与 C797X 的突变则被诊断为主要的机制。
单克隆抗体也能够标靶典型 EGFR 突变
尔必得舒,一种能够与 EGFR 外细胞互动的单克隆抗体,有着利用典型的 EGFR 突变来抗非小细胞肺癌出色的能力,能够阻挡二聚化与配体的融合。
如何治疗非典型的 EGFR 突变病患?
这些对抗非典型 EGFR 突变的药效还是非常不明确。
Exon 20 的殖入在非典型 EGFR 突变中很常见,位于接近 C- 螺旋主体与 N 叶。 这些突变主要来在于酪胺酸激酶抑制剂产生的抗体,这个抗性到现在还是不能够完全被解读。
未来临床前模型需要完全了解与克服抗性机制
至今临床前模型的非典型基因病患 (不管是人源性肿瘤动物模型还是基因编辑老鼠模型) 数量不足,造成在研究使用 Exon20 的疗法上的障碍。 目前许多对酪胺酸激酶抑制剂的Exon20突变反应数据都是从试管实验来制作出替代细胞膜型,也只有少数独特的PDX模型可以提供使用。
当许多非小细胞肺癌的从头 (de novo) 机制与后天性抵抗还未被发现,临床与临床前预测模型皆被要求需要能够理解前述性质,也需要用来评估新的药剂与联合治疗来克服抗性,帮助病患找到最适合他们的治疗方法。
延伸阅读:
- Yasuda H, Kobayashi S, Costa DB. EGFR exon 20 insertion mutations in non-small-cell lung cancer: preclinical data and clinical implications. Lancet Oncol 2012;13:e23–31.
- Yang M, Shan B, Li Q, et al. Overcoming erlotinib resistance with tailored treatment regimen in patient-derived xenografts from naïve Asian NSCLC patients. Int J Cancer 2013;132:E74–84.
- Brand TM, Iida M, Wheeler DL. Molecular mechanisms of resistance to the EGFR monoclonal antibody cetuximab. Cancer Biol Ther 2011;11:777–92.
- Yasuda H, Park E, Yun CH, et al. Structural, biochemical, and clinical characterization of epidermal growth factor receptor (EGFR) exon 20 insertion mutations in lung cancer. Sci Transl Med 2013;5:216ra177.
- Yang M, Xu X, Cai J, et al. NSCLC harboring EGFR exon-20 insertions after the regulatory C-helix of kinase domain responds poorly to known EGFR inhibitors. Int J Cancer 2016 Jul 1;139(1):171-6.