人源化小鼠模型可以模拟患者反应,评估免疫治疗药物。这需要更多可译的临床前肿瘤免疫研究,以便深入了解药物在临床试验中的性能。
在这篇文章中,我们将讲述hCD34 +造血干细胞(HSC) -移植人源化模型的应用,包括模型选择、研究设计、时间进度表和对常见误解点评的建议。
人源化:hCD34+ vs PBMC
通常可分别通过以下两种方式生成人源化小鼠模型:
- 稳定移植脐血hCD34 +造血干细胞,刺激各种祖细胞发育。
- 将人外周血单核细胞(PBMC)瞬时植入免疫缺陷动物中。
以上两种方法有各自明显的优劣势; 但本文重点分析更复杂的hCD34 + HSC人源化模型的产生和使用。
小鼠模型选择
对于临床前研究,目前还没有一个完美的人源化模型。由于人体免疫系统的复杂性和变异性,您必需根据研究目标选择恰当的模型。
根据所关注的免疫群体和测试药品的作用机制,您可选择具有恰当免疫细胞特性的不同模型。例如,人源化NSG TM小鼠(<43/>)或人源化NOG®小鼠(<66 />)鉴于其优势淋巴谱系,他们是研究T细胞反应的常见转基因模型。
HuNSG-SGM3和HuNOG-EXL的优势谱系相似,但其也呈现更丰富的功能性骨髓谱系。
现在,有更先进的肿瘤免疫学研究模型。Taconic hIL-6 NOG小鼠的巨噬细胞和单核细胞数量比huNOG-EXL小鼠多,而hIL-15 NOG和hIL-2 NOG小鼠则适用于NK细胞重建。然而,与上述模型相比,这些模型相对较新且表征较少,因此使用前需要进一步验证和优化。
根据淋巴和骨髓重建选择模型
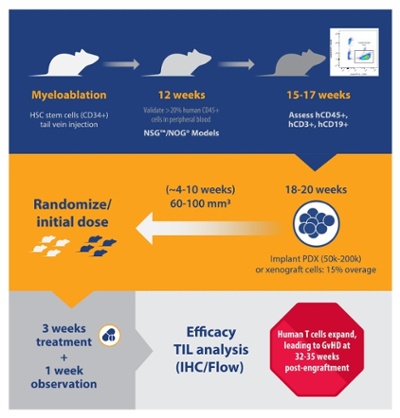
对于huNSG和huNOG,每个移植体所需供体和动物数量影响获得理想型动物的前置时间。前置时间从两周(即每个移植体需3个供体和15只小鼠)到数月(即每个移植体需超过5个供体,和 25只小鼠)不等。如需特定的HLA类型,也可延长时间。
在移植后6和12周便可检测到B和T细胞移植水平,但huNSG和huNOG通常在移植后15至17周左右检查。此外,研究通常评估数量百分比而非绝对细胞计数。
对于huNSG / huNOG,hCD45变化范围很大,在20~80%之间浮动,且hCD3 +亚群在10~50%之间浮动。而对于huNSG-SGM3 / huNOG-EXL,在植入后15~17周hCD33%在2至25%之间浮动。
选择更接近单个供体中值的含人类T或骨髓细胞群的小鼠进行研究。建议在单一研究中保持所有供体的平均hCD45%和hCD3%相似。虽然这是一项尝试减少变异性的研究,但到目前为止还没有数据表明hCD45%和hCD3%的变异性影响肿瘤生长或药物反应。
通常在移植后约18周将肿瘤植入小鼠体内。在这些模型中,植入水平通常可持续到移植后35周。
传统异种移植与患者源异种移植?
从本质上讲,传统
细胞系源异种移植模型变化较小,且比患者源异种移植(PDX)更具表征史。然而,大量充分表征的临床相关PDX模型揭示了疾病适应症,这在传统异种移植模型中可能无法获得。
PDX数据库<97 />对模型数据进行核实整理,如进行RNA测序,以便提供基因库的转录水平。这些功能强大的模型可识别特定的靶抗原,筛选候选药物,并支持快速简便地选择所需模型。
但是请记住一点,可能没有对集合中所有的PDX模型进行增长验证。在这种情况下,专家建议人源化研究前进行快速模型验证,但该举措可能会延长药物开发计划的总时间。
人源化模型的常见误解
误解:可以像任何免疫缺陷动物一样安置和处理人源化小鼠。
与没有任何移植的免疫缺陷小鼠相比,人源化小鼠非常脆弱且需要特殊护理。通常人源化小鼠有皱褶粗糙的毛,有时可能蜷着。
具体来讲,huNSG-SGM3和huNOG-EXL比huNSG或huNOG脆弱得多; 因此,建议随机化前对更多小鼠进行移植(即,超限植入)。通常,建议每个移植体超限15%。
误解:肿瘤不会在人源化小鼠中自行消退。
可能由于移植物抗肿瘤效应(GvT)(供体T细胞攻击移植的PDX细胞),在人源化模型中偶尔也会发生肿瘤自行消退现象。该效应具有肿瘤依赖性,植入相同供体的小鼠在消退时可能会有所不同。
此外,该效应可能不是为了HLA匹配,因为没有证据表明供体与PDX HLA的不匹配会影响PDX生长或摄取率。这就是需要足够超限量的原因,特别是如您在之前关注的同一模型中看到过GvT。
误解:人抗PD1或抗PD-L1作为阳性对照。
临床上的主要免疫疗法制剂,抗PD-1药物如派姆单抗(pembrolizumab)(Keytruda®,Merck)或纳武单抗(nivolumab),(Opidvo®,Brisol-Myer Squibbs)和抗PD-L1 阿特珠单抗(atezolizumab)(Tecentriq®Roche/ Genentech)均为联合疗法中与测试药物组合的理想药物。
但不应期望将抗PD-1 /抗PD-L1作为阳性对照。
这些药物的疗效在很大程度上取决于供体与供体的可变性。那些PD-L1阳性的肿瘤不能确保对抗PD-1治疗有反应。
最近一项研究在4,000多名患有5种晚期或转移性实体瘤的患者中进行了8项随机对照临床试验。结果表明与常规疗法相比,抗PD-1或抗PD-L1单一疗法使PD-1阳性(34%)和PD-L1阴性(20%)i患者的生存率提高 。
还有研究表明, PD-L1低或无表达的患者对抗PD-1治疗有反应。这充分说明抗PD-1 /抗PD-L1不具有100%的反应率,虽然PD-L1阳性肿瘤患者为较好的响应人群,但仅此一点并不是选择抗PD1 / PD-L1治疗的适当生物标志物。
最新研究表明较高的肿瘤突变负荷与抗PD-1 / PD-L1治疗的较大反应相关,且可能是选择模型的良好起点。
误解:肿瘤生长抑制是评估测试药品功效的唯一指标。
除功效外,通过肿瘤生长抑制(TGI)测量的肿瘤微环境和肿瘤浸润淋巴细胞(TIL)为重要基准。为更全面地评估测试药品的药效学特性,我们有必要预测多个读数。
可通过流式细胞术、免疫组化技术以及经流动、ELISA或ELISPOT的细胞因子产生检查免疫细胞群和分布,以便更稳健地评估药物性质。通常我们使用14色TIL板提供携PDX肿瘤的huNSG基线免疫表型。
总结
hCD34 + HSC人源化模型是免疫治疗药物研发的有用工具。他们通过细致的模型选择和研究设计,提供大量关于人类新药物功效和PD效应的数据,进而推动肿瘤免疫研究进展。