本文探讨了基因工程类器官和细胞系的应用,以扩大和加速抗癌药物的发现和开发。我们首先简要概述了用于开发工程类器官/细胞系的两种主要方法(即慢病毒转导和 PiggyBac),之后对生成此类模型的典型工作流进行了概述。我们介绍了多个病例研究,以展示其在靶点验证和体外/体内疗效研究中的应用。
为什么使用基因工程类器官和细胞系?
细胞系和类器官可以轻松进行改造,以稳定地表达转基因、报告基因结构和靶向基因改变。这种改造极大地扩展了此类模型的应用范围。例如,对肿瘤类器官进行改造以表达生物发光探针,可用于建立原位患者来源异种移植(PDX)模型,从而能够实时可视化肿瘤对治疗的应答情况,并评估相关肿瘤环境(TME)中的应答情况。
此外,可以引入已知在患者人群中代表性不充分的特定基因突变,从而生成原本不存在的高度临床相关的临床前模型。此外,开发具有特定突变特征的类器官模型库,可以有助于识别目标患者人群及开发精准医疗方法。
基因工程体外模型正越来越多地用于实现与药物发现和开发相关的以下类型的研究:
- 作用机制
- 靶标发现/验证
- 耐药性
- 通过报告基因系的治疗应答情况
用于生成基因工程体外模型的两种方法
多种已发表方法可用于生成稳定表达的工程模型。我们介绍两种常用的方法,如下所述:慢病毒转导和 PiggyBac。上述平台可用于开发各种工程模型,包括:
- 标准/诱导性过度表达
- 标准/诱导性敲除
- 敲除
- 敲入
CRISPR/Cas9 基因编辑也在上述两个平台中使用。该项多功能且高效的技术为哺乳动物类器官和细胞系模型的靶向基因工程,特别是用于诱导特定的基因改变,开辟了巨大的可能性。
下图描述了开发工程类器官的通用流程。
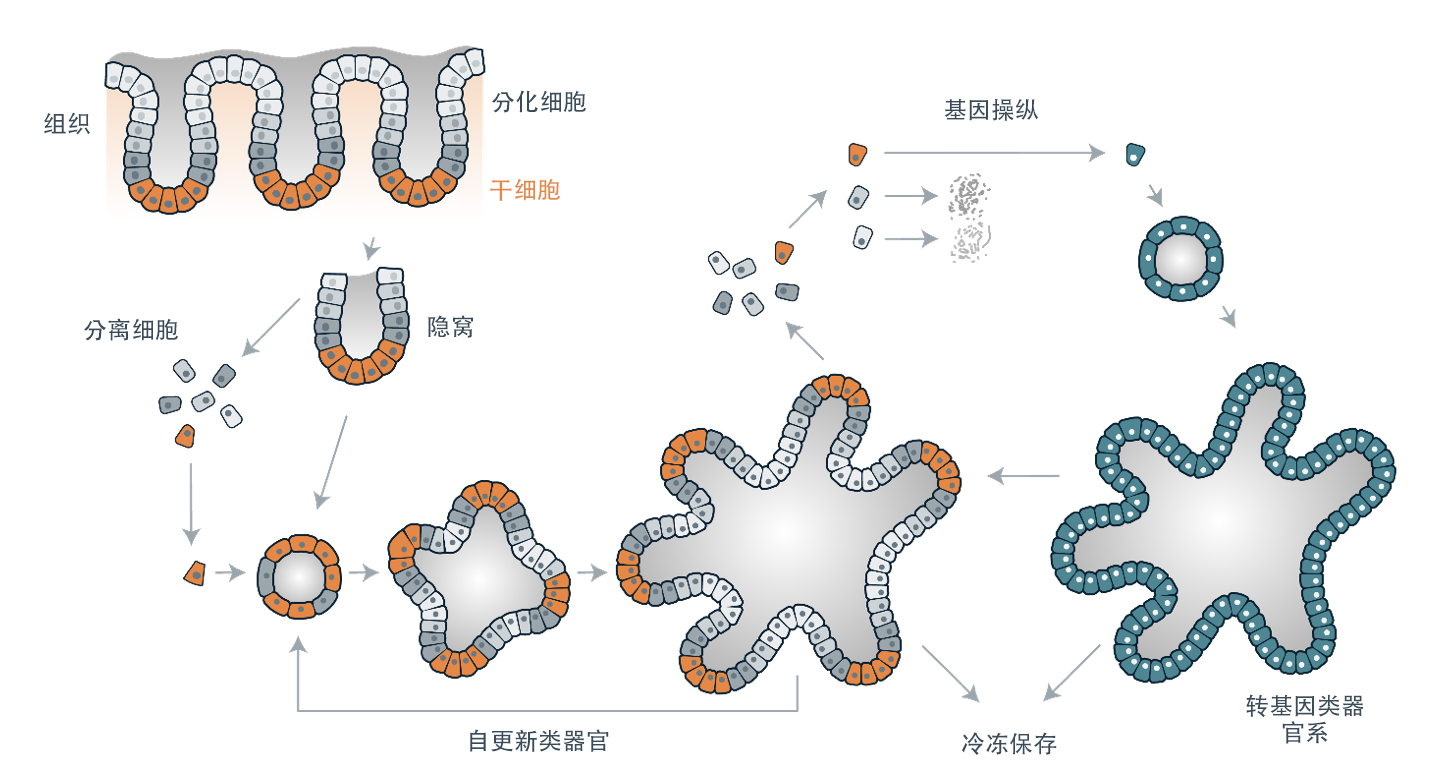
通过靶向单个干细胞,转基因类器官可以通过克隆扩增和冷冻保存获得(绿色)。相反,分化细胞不能形成新的类器官。摘自 Menche & Farin. Strategies for genetic manipulation of adult stem cell-derived organoids. Experimental & Molecular Medicine volume 53, pages 1483–1494 (2021). 获取网址:https://www.nature.com/articles/s12276-021-00609-8。基于知识共享署名 4.0 国际许可协议使用:https://creativecommons.org/licenses/by/4.0/
慢病毒转导
慢病毒转导被视为可以稳定修饰类器官和细胞系的高效方法。慢病毒无需细胞分裂来进行转导,它们将其基因组整合至受感染宿主细胞基因组中。该技术广泛应用于多种应用,包括转基因的传递和稳定表达、小发夹 RNA(shRNA)结构以及通过 CRISPR/Cas9 基因编辑靶向序列的单导 RNA(sgRNA)表达盒。
在使用慢病毒转导方法之前,应考虑几个可能存在的挑战。将病毒基因组随机插入宿主基因组可能导致内源性基因出现无法预测的破坏(尽管与肿瘤逆转录病毒相比程度较低),整合数量可变,通常,慢病毒载体仅限于最高约 8 kb 的 DNA 序列。超过该大小,病毒滴度可能会大大降低。
PiggyBac
PiggyBac 是一种被设计为双质粒系统的非病毒平台,其中一个系统包含表达盒(转座子),另一个系统包含 PiggyBac 转座酶的编码区,以促进转座子在分散于基因组中的 “TTAA” 四核苷酸位点的整合。下图说明了 PiggyBac 转位的机制。
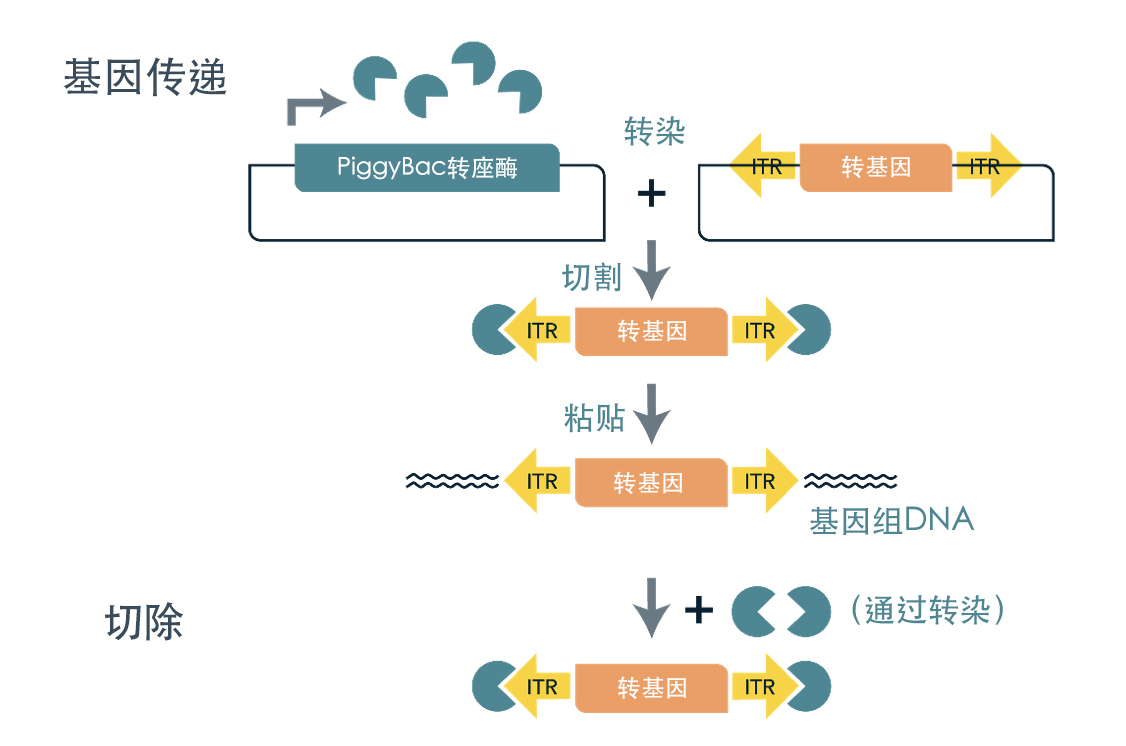
PiggyBac 转位机制。(a)在转染细胞中,由 PiggyBac 转座酶表达载体表达转座酶,然后识别并结合到转基因载体质粒的特定反向末端重复序列 ITR),并从原位点切割转基因DNA序列。然后,转基因 DNA 序列整合到靶细胞的基因组 DNA 中。(b)对于切除,通过转染 PiggyBac 转座酶表达载体重新表达转座酶,导致转基因在基因组 DNA 中的 ITR 处被切割,从而造成插入的转基因从基因组 DNA 中移除。摘自 Zhang, M., et al. (2017). Gene Delivery and Expression Systems in Induced Pluripotent Stem Cells. In: Sasaki, K., Suzuki, O., Takahashi, N. (eds) Interface Oral Health Science 2016. Springer, Singapore.获取网址:https://doi.org/10.1007/978-981-10-1560-1_11。基于知识共享署名 4.0 国际许可协议使用:https://creativecommons.org/licenses/by/4.0/
PiggyBac 于 2005 年首次被用于生成工程化哺乳动物细胞,并被证明能够在不降低转位效率的情况下实现大插入片段(高达 14 kb)的稳定表达。与慢病毒一样,该系统的应用也广泛,包括通过 CRISPR/Cas9 促进靶基因编辑。PiggyBac 也适用于难以转导的细胞。
PiggyBac 将完全完整的基因货物传递至宿主基因组中,允许稳定地传递和表达多个转基因,并且可以通过滴定转座子与转座酶的比率来调节整合拷贝的数量。PiggyBac 存在多个潜在性挑战,包括将突变引入内源性基因以及控制克隆中拷贝数的可能性。
生成工程化模型的典型工作流
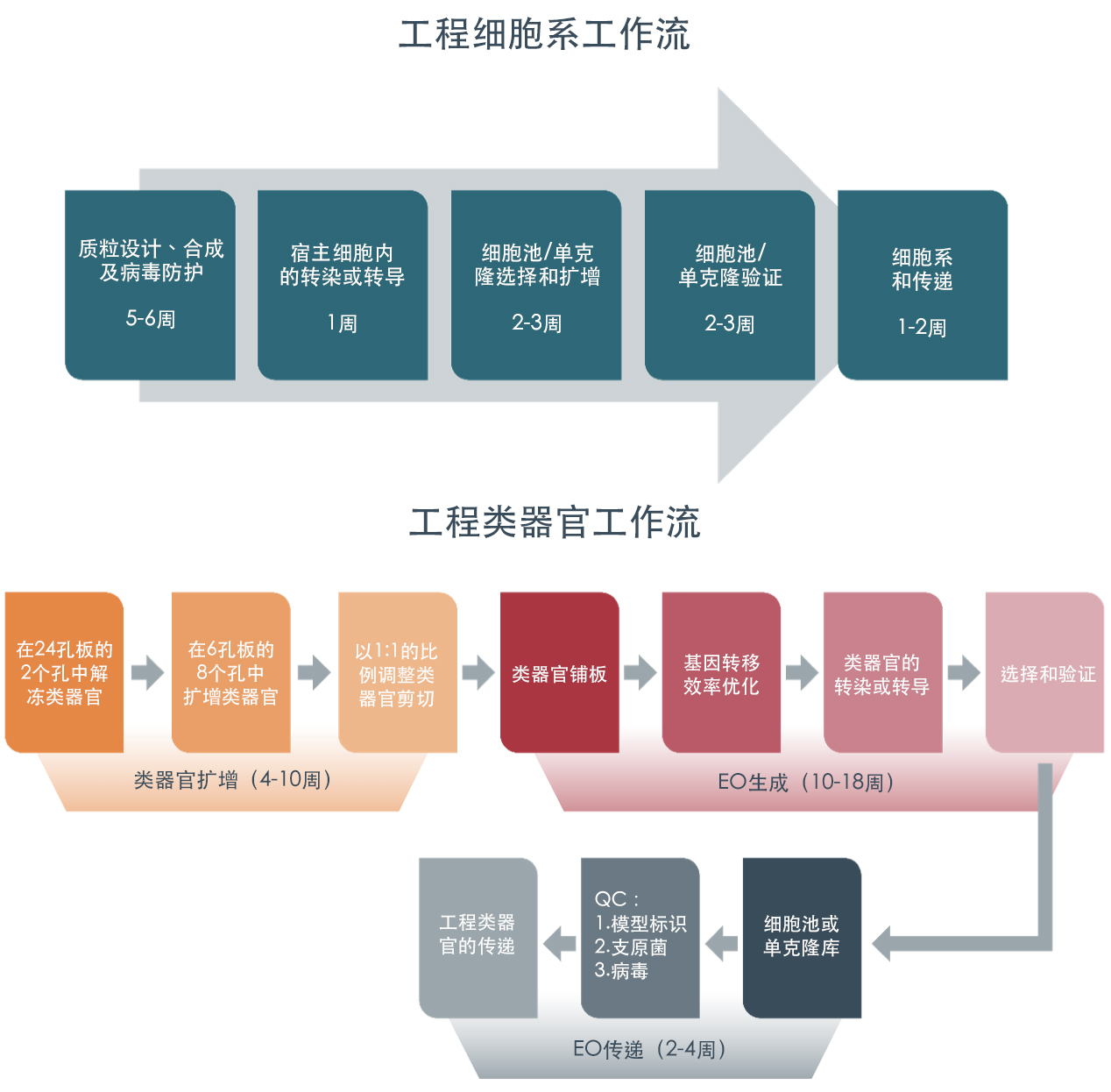
产生基因工程类器官和细胞系的典型时间范围分别为 16-32 周和 11-15 周。下面所示的工作流说明了生产各个工程模型所涉及的主要步骤和每个步骤的大致时间。时间的可变性与一些因素有关,包括模型系统、DNA 修饰平台以及参数的设计和优化。每个工作流的主要步骤包括:
- 质粒设计
- 转染或转导
- 克隆选择和验证
- 细胞系传递
病例研究
EGFR-Del19-T790M-C797S 耐药细胞系的开发(慢病毒转导)
PC-9 是 EGFR 基因外显子19缺失的肺腺癌细胞系。如下图所示,开发了一种基于 PC-9 的工程细胞系,以过度表达 EGFR-Del19-T790M-C797S(奥希替尼(AZD9291)耐药肿瘤中鉴别的最常见 EGFR 突变体之一)。
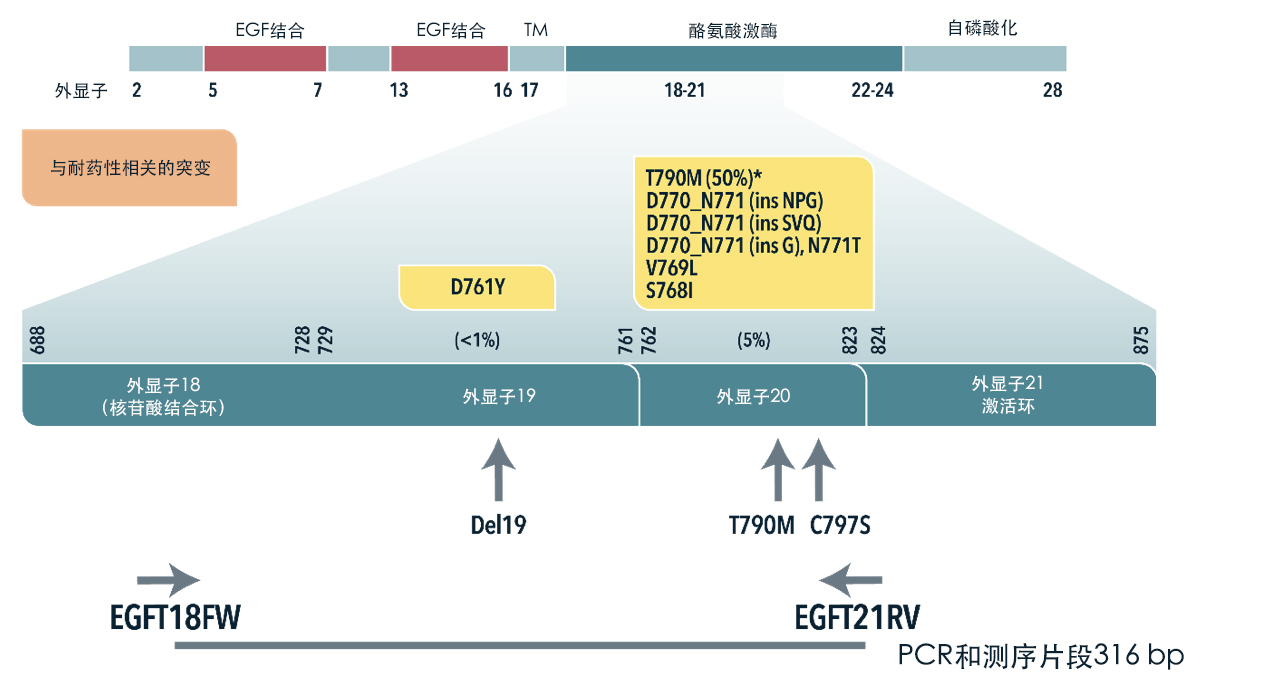
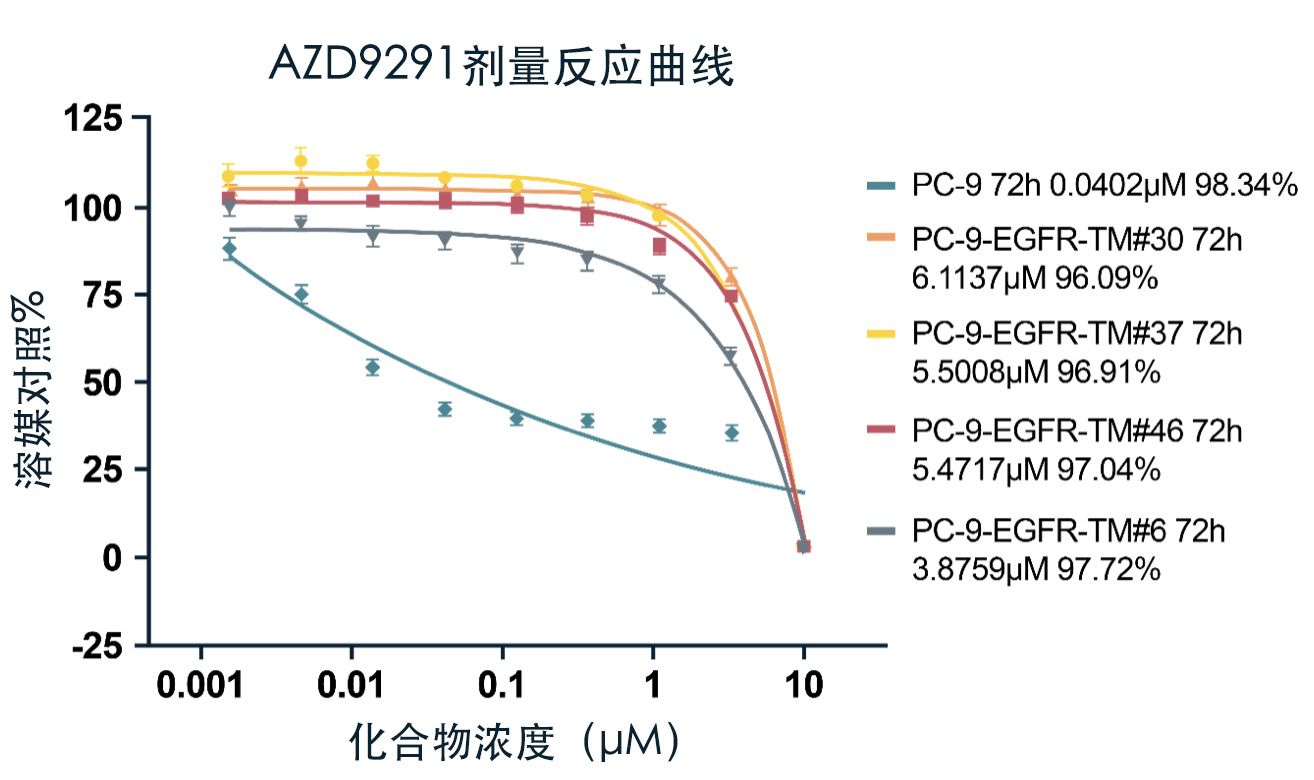
克隆的开发和验证采用了包括基因测序在内的多种测定方法。选择四个克隆用于进一步分析,两个中等和两个高表达水平克隆。如下图所示,EGFR-Del19-T790M-C797S 的过度表达使细胞对奥希替尼(AZD9291)产生耐药性。关于对奥希替尼用于 EGFR 外显子 20 插入的 NSCLC 临床前评估的讨论,请阅读我们以前的文章。
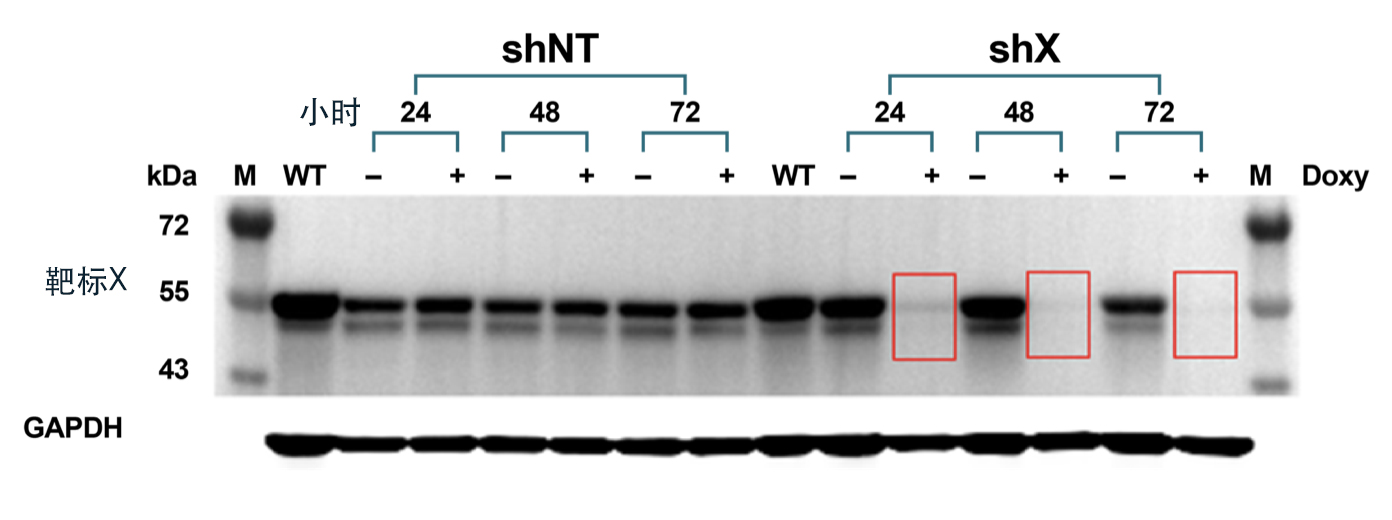
通过 shRNA(慢病毒转导)诱导基因敲除
在 U2OS 细胞系中建立了诱导基因敲除模型。如下图所示,在存在诱导剂多柔比星(“Doxy”)的情况下,自 24 h的首个时间点开始,shRNA(shX)成功敲除了“靶标X”[见红色方框]。随后的分析表明,与阴性对照组(shNT)相比,靶标X的敲除显著抑制了细胞生长。
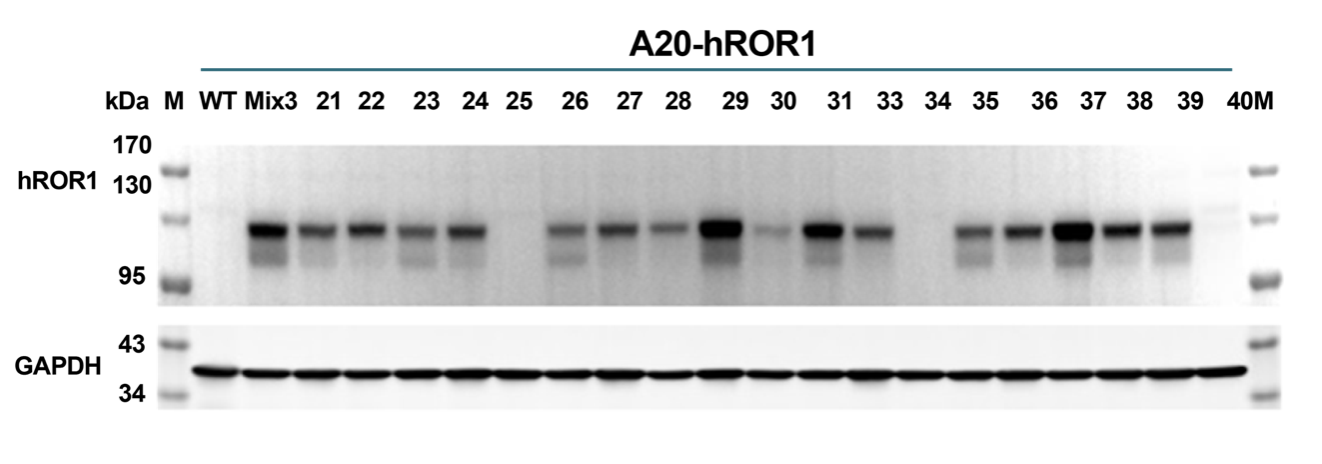
A20-hROR1 (PiggyBac)
在观察到 A20 细胞系中的慢病毒转导具有低效性(即,在抗生素选择存在下,细胞活力较低)后,使用 PiggyBac 成功地将hROR1引入 A20 细胞系。如下所示,成功地产生了多种不同 hROR1表达水平的克隆。该重要模型可用于评估 hROR1 靶向免疫疗法,目前正在进行体内验证。
通过 CRISPR 敲除 MC38 中的S TK11 基因(PiggyBac)
通过 PiggyBac 使用 CRISPR 基因编辑在小鼠结直肠癌细胞系 CT26 中成功敲除 STK11 基因(LKB1)。体内验证研究表明,与亲本细胞系相比,该工程细胞系中的肿瘤生长明显更快,STK11 敲除 CT26 模型中的 PD1 疗效被消除。
此外,如线性混合模型分析所示,曲美替尼与抗 PD1 剂联合用药对 CT26-STK11 敲除模型产生了显著的抗肿瘤活性(与对照组相比,p=0.035)。
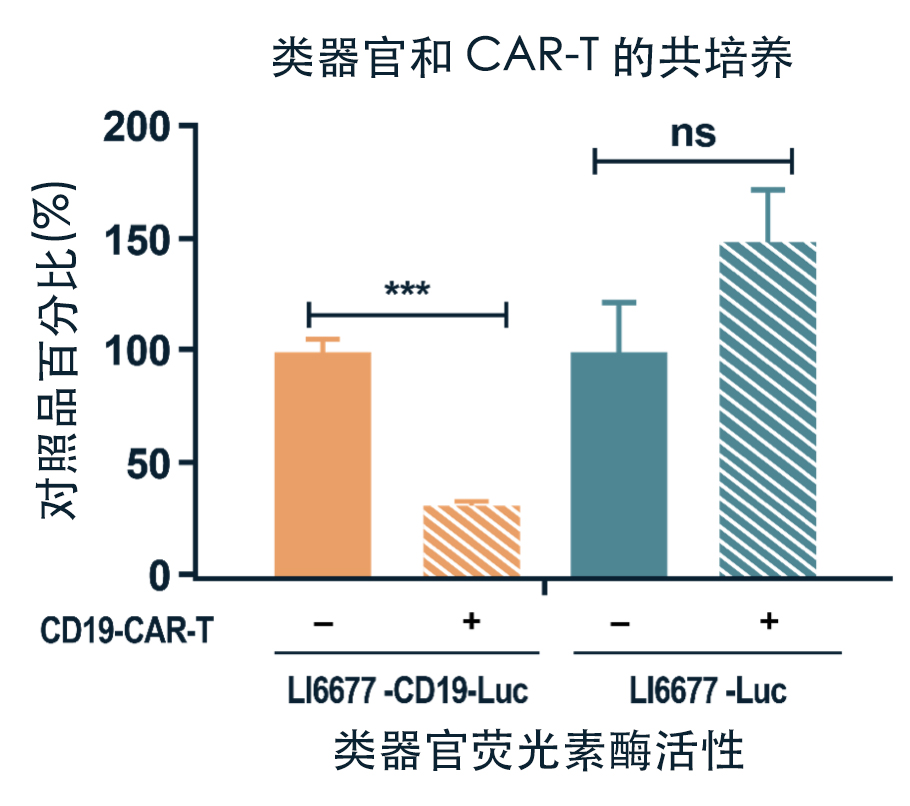
肝癌类器官(PDXO LI6677)工程表达人 CD19 和荧光素酶
LI6677 类器官系被改造成与报告荧光素酶结合表达人体免疫细胞靶 CD19,以定量评估 CD19 CAR-T 免疫疗法的抗肿瘤效果。为此,将工程类器官与 CD10 CAR-T 细胞共培养 48 h,荧光素酶活性显示了 CD19 CAR-T 细胞对肿瘤类器官的特异性杀伤。
结论
类器官和细胞系扩增了用于药物发现的体外模型数量。基因工程类器官和细胞系的应用可以有益于广泛的临床前研究,通过适当的前期规划,此类模型有可能提高临床前数据的可翻译性。在生成工程模型之前,建议尽早与工程体外模型专家进行讨论,包括深入了解如何规避任何潜在陷阱的专家,以便您的模型和下游研究获得成功。
冠科生物在工程类器官和细胞系方面拥有丰富经验,目前我们提供26种工程类器官模型,涵盖多种癌症类型,可用于多种类型的研究,包括体内成像、免疫疗法和作用机制研究。