类器官技术的进步催生了基于干细胞的新型模型,这些模型反映了体内细胞来源组织的重要结构和功能特性。这些模型提供了更具临床相关性的平台,可以帮助研究人员更好地选择药物以推动临床进展。
本文探讨了类器官类型之间的主要差异,以及为什么成体干细胞衍生的体外类器官是与患者相关的优质 3D 模型。
类器官的定义
从历史上看,“类器官”的使用并不严谨,主要是指在不存在附着基质的情况下培养时,形成 3D 结构的细胞聚合物。
但是,类器官目前通常描述具有以下特征的 3D 结构:
- 建立或保留被建模器官/组织身份的细胞(干细胞及其后代),
- 在原始器官/组织中发现的多种细胞类型,
- 原始器官/组织特定功能的某些方面,以及
- 具有与原始器官/组织相同内在组织原则的自我组织。
类器官与球状体有何不同
3与其他 3D 模型不同,3D 类器官可从健康组织和患病组织(例如肿瘤类器官)中提取。例如,来自肿瘤细胞的球状体(也称为“肿瘤球”)由单个细胞类型或多细胞混合物建立,可来源于干细胞、原代细胞、永生化细胞系或人体组织。
在选择肿瘤球可获得大量具有高复制潜力的低分化细胞(即,主要为癌症干细胞[CSC])的条件下,对肿瘤球进行培养。
球状体通常包含细胞层。有些细胞层暴露在表面上,有些则埋在球体内。因此,球状体具有异质性,可能包括增殖、非增殖或坏死的含氧或缺氧细胞。
人源肿瘤球的长期培养也仍然具有挑战性。这可能是由于提取和维持活细胞的固有技术困难导致。例如,数据表明,此类肿瘤球仅短暂保留了原始肿瘤的重要特性。
相比之下,类器官通常来源于:
- 多能干细胞(PSC)(即胚胎干细胞或诱导多能干细胞 [iPSC])或;
- 多能器官特异性成体干细胞(ASC)。
类器官可以仅由上皮细胞组成,或由上皮细胞和间充质细胞的混合物组成。起始物料的选择导致类器官及其应用之间的关键差异,包括肿瘤学研究和药物研发。
PSC 衍生类器官和 ASC 衍生类器官发育之间的主要差异
因为 PSC 从早产组织分化为近原生器官型培养物,所以 PSC 衍生类器官通常用于模拟器官形成。与 ASC 衍生类器官相比,需要一个额外的步骤来驱动向胚层的分化,从而产生所需的类器官(内胚层、外胚层和中胚层)。
这可通过使用特定的生长因子补充细胞培养基来完成。对于 iPSC,成体干细胞分化为 PSC,并从基因方面重新编程为内胚层、外胚层或中胚层。
相反,ASC 衍生的类器官通过使用优化方案由组织特异性干细胞群建立。这些使纯化的单个 ASC 或组织特异性微结构成为源材料。
优化培养条件以保持干细胞的自我更新和分化潜力,补充关键的组织特异性干细胞生态位因子,并使用 Matrigel 作为细胞外基质的替代物。
这是一种更快的方法,因为 ASC 无需重新编程来分化成适当的谱系。省略间充质生态位也有助于生成更稳健的模型,因为间充质细胞会影响培养稳定性。
因为 ASC 类器官不需要额外的基因重编程和分化步骤,因此 ASC 类器官可更快建立。该类类器官更容易进行扩展,长期在体外高度稳定,并被证明与患者相关且具有临床预测性。
随着方案的不断推进,类器官的开发越来越有可能用于大量正常和患病组织,包括许多类型的实体癌。
ASC 类器官:唯一临床相关类器官模型
虽然 PSC 可通过基因工程诱导致癌或抑癌基因突变,这些过程会产生瘤样生长,但缺乏每种临床肿瘤基因组成的复杂性。这一点只能通过从患者材料开始进行概括,这也是 ASC 肿瘤类器官是可用于肿瘤药物开发的最具临床相关性的模型的主要原因。
许多出版物(例如,此处、此处和此处)中的数据已将成体干细胞衍生的肿瘤类器官确定为临床最相关的3D体外模型,以显示以下内容:
- 长期培养和冷冻保存后的基因组和表型稳定性,
- 增强的临床预测性,以及
- 相对于体内模型的易扩展性。
从多种保留 CSC 成分的原发性人类肿瘤中开发出3D体外类器官。肿瘤类器官主要来源于上皮细胞,通过使用直接来自患者肿瘤的组织(人源类器官)或在小鼠体内扩增的患者肿瘤组织作为 PDX(PDX 来源的类器官),可从广泛的癌症类型中产生肿瘤类器官。
这两种类型均已被证明能够可靠地概括人类癌症组织的复杂性,包括CSC及其分化的后代。
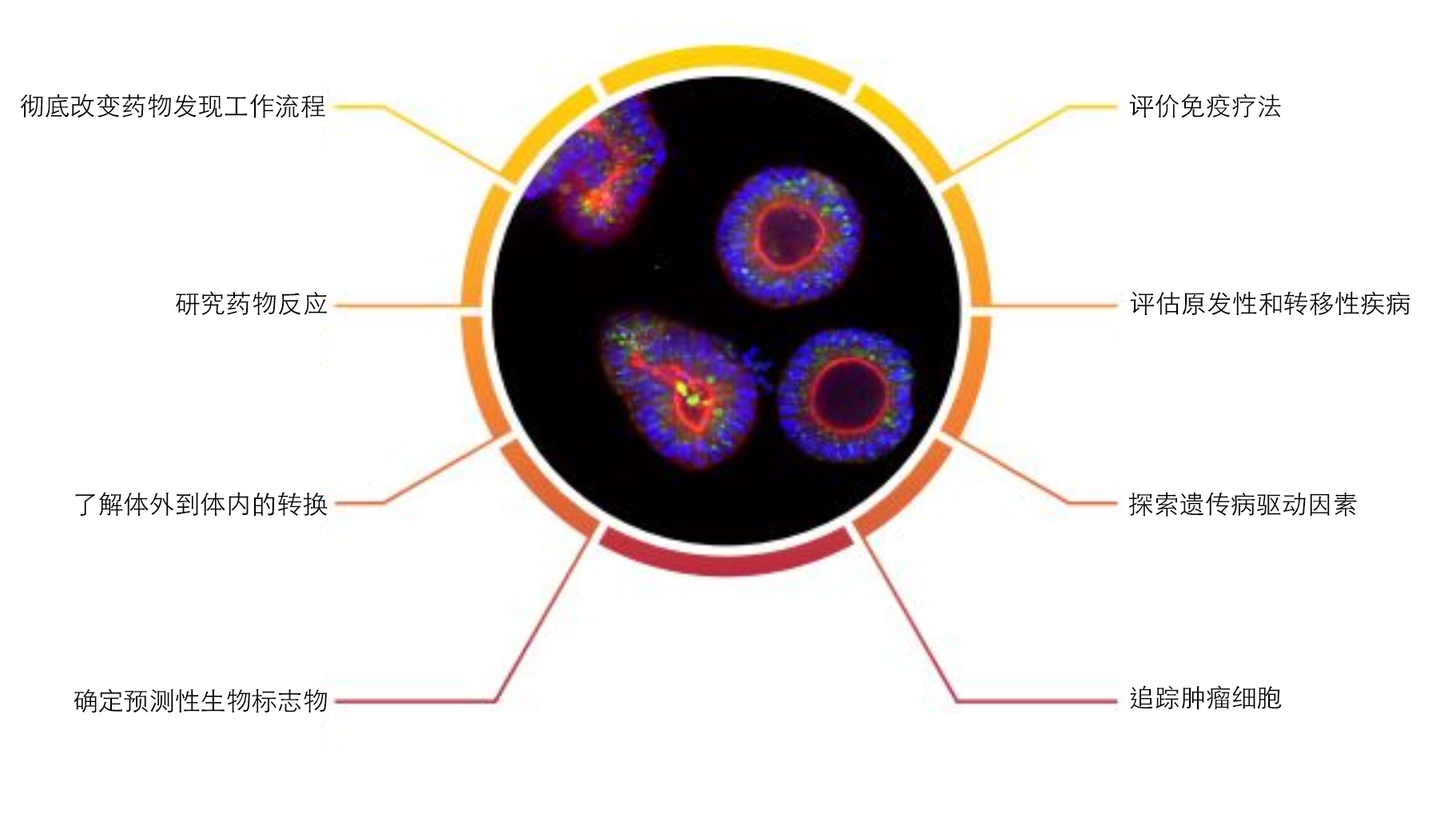
肿瘤类器官可以加速肿瘤药物开发
肿瘤类器官已成为癌症药物发现和开发的强大预测性临床前模型。鉴于其独特属性,已通过开发生物样本库(具有匹配的健康组织)来增加其价值,这些生物样本库捕获表型和遗传患者群体的异质性,支持大规模研究,并确保重复研究的可用性。
这些大型“活体” 肿瘤类器官生物样本库可让您实现将“患者带入实验室”,并可用于开展大规模群体研究,考察治疗反应并识别生物标志物。这种方法相当于临床试验,但仅在培养皿中开展。它加快了药物开发并降低了肿瘤候选药物的高磨耗率。
肿瘤类器官共培养也被用于 I/O 应用。这提供了另一个临床前平台,与癌细胞系相比,该平台更具临床相关性,可在体外使用肿瘤类器官与各种人类免疫细胞类型(包括TIL、CAR-T 或特定的肿瘤微环境成分)的共培养物来测试新型免疫疗法。此类研究可提供导致抗肿瘤反应的关键见解,并使药物筛查能够测试新型免疫疗法和药物联合使用的疗效。
结论
可以使用不同类型的干细胞(PSC和ASC)产生类器官。然而,经证明只有专门的方案可产生临床相关的肿瘤类器官,从而加速癌症药物的开发。
观看我们的点播网络研讨会,我们将会采访冠科生物高通量筛选负责人 Michiel Fokkelman。Michiel 是一位在高内涵成像领域具有丰富经验的专家,他将分享他在这一关键研究领域中的丰富知识和见解。本期,您将了解高内涵成像的最新发展以及它如何彻底改变药物发现和临床前药物开发。