新一代 4D-DIA 蛋白质组学技术将 4D 蛋白质组学与数据非依赖采集(DIA)策略相结合,在传统蛋白质组学质谱三个分离维度(色谱保留时间、质荷比和MS/MS指纹图谱)的基础之上,增加第四个分离维度——离子淌度,并实现数据的“无损采集”,从而避免随机性而导致的数据失衡。
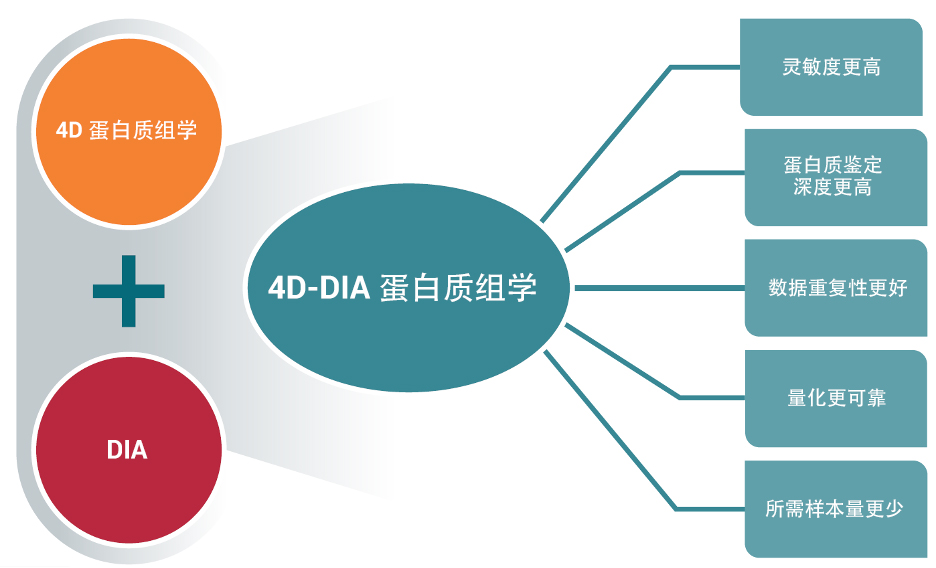
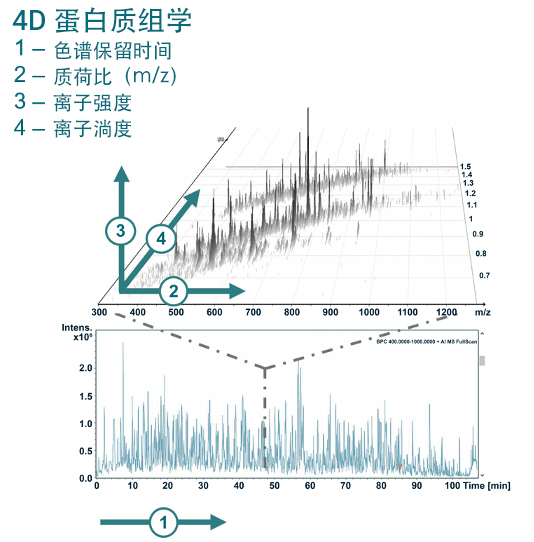
什么是 4D 蛋白质组学?传统的基于 LC-MS/MS 的自下而上(Bottom-up)蛋白质组学基于三个维度分离肽段:色谱保留时间(RT);质荷比(m/z)和离子强度。 离子淌度分析是一种根据离子的淌度,借助受电场影响的惰性气体(通常为氦气或氮气)分离离子的气相技术。于LC-MS/MS联用,增加离子淌度作为肽离子分离的另一个维度,这使得基于质谱的蛋白质组学进入了一个新时代。 4D 蛋白质组学大幅度地提高了扫描速度和检测灵敏度,实现蛋白质组学在鉴定深度、检测周期、定量准确性等性能上的全面提升。 |
 |
串联质谱(MS/MS)数据采集有两种数据采集策略:
DDA 模式:质谱仪选择固定数量的强度最高的前体离子。然后,在串联质谱法的第二阶段,对这些前体离子进行碎裂分析。
DIA 模式:质谱仪将质谱整个全扫描范围分为若干个窗口,并循环地对每个窗口中的所有离子进行选择、碎裂、检测。
DIA 策略通过“无损采集”所有可能的数据,避免随机性而导致的数据失衡。然而,“全采集”的数据采集策略会使得谱图高度复杂,所以后续的数据解析更为挑战。

对于没有结合离子淌度分离的传统 DIA,最大的挑战就在于其混合谱图难以可靠解析。在定量过程中,主要依据色谱洗脱时间(保留时间)来进行匹配。但是,由于共洗脱现象的普遍存在,仅仅依靠色谱洗脱时间是不够的,存在很多的干扰信号,而影响了检测结果的准确性。
4D 技术代表性的离子淌度分离,提供了额外维度的校准信息。能够更准确从 DIA 的混合谱图中鉴别出具体的肽段信号,有效降低了谱图的复杂性,全面提升了 DIA 检测的准确性和可靠性。
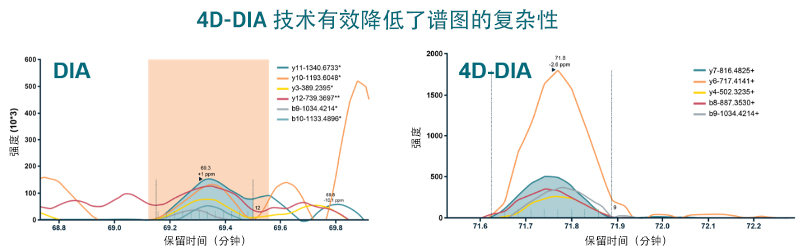
图、EVGSHFDDFVTNLIEK 肽段在传统 DIA(左)和 4D-DIA(右)中校正后的色谱图。可以看到上图的传统 DIA(左)方法中,存在较高的干扰信号;而在下图的 4D-DIA(右)中的信号背景很干净。
在 4D-diaPASEF 的扫描模式中,与离子淌度相关的 CCS 值和 m/z 之间有一定的相关性。因此四级杆可以利用这个特征逐步扫描来采集近乎 100% 的离子信号,从而极大提升检测的灵敏度和深度
而在没有离子淌度分离的传统质谱法蛋白质组学分析中,这些信号只有一小部分可以被采集。
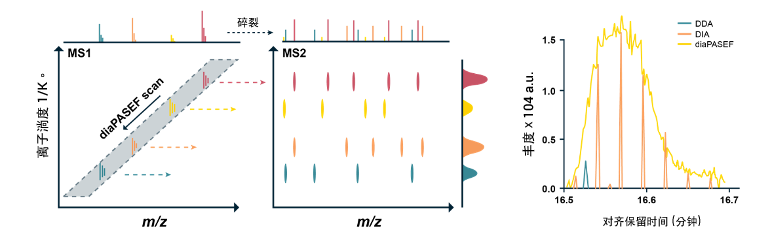
图、基于 4D 平台的 4D-DIA 技术可实现近乎 100% 的离子利用率。左,4D-DIA 中的数据采集模式;右,4D-DIA 和 DDA 及传统 DIA 离子利用率的对比。(参考来源:Florian Meier, et al.Nature Methods.)
4D-DIA 相比于传统方法能够更加准确的识别和定量低丰度的蛋白,进而显著提升蛋白质组学检测深度。

图、在 200ng HeLa 裂解液的 120 分钟单针实验中,可鉴定超过 7,500 个蛋白,并且三次实验共同定量了 6,974 个蛋白,数据完整性高达 96%;而在常规蛋白质组学中,通常需要 µg 级的样品来检测约 5,000 个蛋白。
基于卓越的仪器性能和先进的数据采集方法,4D-DIA 技术可以进一步提高灵敏度的极限。而即便是在如此痕量的情况下,4D-DIA 在蛋白质定量上也能实现了 85% 的数据完整性。
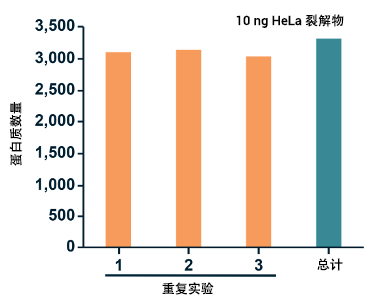
图、在 10 ng HeLa 裂解液的 120 分钟单针实验中,可鉴定超过 3,000 个蛋白,并且三次实验共同定量了 3,323 个蛋白,而在相同的实验研究条件下,4D-DA 模式最多只能鉴定 2,723 个蛋白。
与我们分享更多与您项目相关的信息!