儿童癌症治疗已取得重大进展,目前高收入国家癌症儿童的5年生存率总体在 80% 左右。尽管取得了这一进展,但在该患者群体中,仍有重大需求未得到满足。中低收入国家癌症儿童的5年生存率分别约为55%和40%,几种儿童癌症的生存前景仍然不容乐观。
例如,患有弥漫性内生性脑桥胶质瘤的儿童2年生存率<20%,基本上没有长期幸存者。患有反复性、复发性或难治性疾病的癌症儿童的生存率也很低。在长期幸存的儿童患者中,许多患者由于接受了积极的手术、化疗和放疗方案而受到长期影响。

图片来源:美国儿童癌症组织
本文对一些使儿童癌症成为药物开发独特挑战的关键特征进行了总结,强调了 2022年的最新进展,并探讨了应对儿童癌症的视角和新机遇。
儿童肿瘤与成人恶性肿瘤有本质区别
与成人肿瘤相比,儿童肿瘤由于其罕见性、异质性和不同的发病机制代表其为一个特殊的挑战。儿童肿瘤约占所有肿瘤诊断的 1%,但遗憾的是,其是儿童疾病相关死亡的最常见原因。
儿童癌症在 1)肿瘤类型、2)分子特征和 3)发病机制方面具有独特性。成人恶性肿瘤主要起源于上皮细胞,通常由长期接触致癌物质引起,与此相反,儿童肿瘤通常来自中胚层或神经外胚层。病因在很大程度上是未知的,遗传性癌症易感性仅在10%的患者中发现。
与成人癌症相比,儿童癌症被认为具有“更安静”的基因组,并且突变频率比成人癌症低 14倍。儿童肿瘤主要表现为非常有限的免疫细胞浸润,因此通常被认为是免疫学上的“冷”肿瘤,最近开发的免疫疗法影响较小。
组织学上属于同一类型的肿瘤通常具有独特的病因和发病机制,这反映在其诊断和临床行为中。因此,需要特定的儿童癌症治疗策略来优化生存机会,同时最大限度地降低长期并发症和影响的风险。
FDA 于2022年批准儿童癌症药物
2022年,儿童癌症治疗取得重大进展。三种药物获批用于新的儿科适应症;
- 阿扎胞苷(Vidaza®),用于治疗幼年型粒单核细胞白血病
- 维布妥昔单抗(Adcetris®),用于治疗霍奇金淋巴瘤
- 阿替利珠单抗(Tecentriq®),首个获批用于儿童肉瘤的PD-L1抑制剂。
2022年批准的肿瘤药物还包括两种降低儿童癌症治疗相关毒性的药物。8月,FDA 批准了依鲁替尼(Imbruvica®),用于治疗患有慢性移植物抗宿主病的儿童患者,在这种情况下,从供体移植的免疫细胞会攻击癌症患者的健康组织。自2017年以来,依鲁替尼已获批用于控制成人的这种疾病,但它是同类药物中首个获批用于治疗儿童疾病的药物。
一个月后,FDA 批准了硫代硫酸钠(Pedmark®)来降低由含顺铂化疗方案引起的听力损失风险。该药物被批准与顺铂联用来治疗1个月以上的儿童患者。
| 获批药物[商品名] | 药理类别 | 药物靶点 | 适应症 | 儿童年龄范围 |
|---|---|---|---|---|
| 阿替利珠单抗 [Tecentriq] |
程序性死亡配体1 (PD-L1)阻断抗体 |
CD274 (PD-L1) | 作为治疗成人和儿童不 可切除或转移性软组织 腺泡状肉瘤(ASPS) 患者的单药 |
2岁及以上 |
| 维布妥昔单抗 [Adcetris] |
CD30定向抗体偶联药物 | TNFRSF8 (CD30) | 与多柔比星、长春新碱、依托泊苷、 泼尼松和环磷酰胺联合治 疗既往未经治疗的高危典型 霍奇金淋巴瘤(cHL)儿童患者 |
2岁及以上 |
| 克唑替尼 [Xalkori®] |
激酶抑制剂 | ALK, MET, ROS1, MST1R (RON) |
治疗患有ALK阳性的不可切除、 反复性或难治性炎性肌纤维母细胞瘤 IMT)的成人和儿童患者 |
1岁及以上 |
| 达拉菲尼 [Tafinlar®] |
激酶抑制剂 | BRAF, CRAF | 与曲美替尼联用,用于治疗既往 治疗后出现疾病进展且无令 人满意的替代治疗方案 并伴有BRAF V600E突 变的成人和儿童不可 切除或转移性实体瘤患者 |
6岁及以上 |
| 曲美替尼[ [Mekinist®] |
激酶抑制剂 | MAP2K1 (MEK1), MAP2K2 (MEK2) |
与达拉菲尼联用,用于治疗既往 治疗后出现疾病进展且无令人 满意的替代治疗方案并 伴有BRAF V600E突变 的成人和儿童不可 切除或转移性实体瘤患者 |
6岁及以上 |
| 阿扎胞苷 [Vidaza] |
核苷代谢抑制剂 | 不适用 | 治疗新诊断为幼年型粒单核 细胞白血病(JMML)的儿童患者 |
1个月及以上 |
| 纳武利尤单抗/ [Opdualag®] |
人程序性死亡受体1(PD-1) 阻断抗体和淋巴细胞活化基 因3(LAG-3)阻断抗体 |
PDCD1 (PD-1), LAG3 |
治疗患有不可切除或转移性 黑素瘤的成人和儿童患者 |
12岁及以上 |
2022年 FDA 肿瘤药物批准
A尽管取得了重大进展,但 FDA 批准的儿童药物数量有限,这突出了开发新的有效儿童癌症药物具有一定的困难,因为儿童癌症的很大一部分遗传驱动因素与成人癌症的驱动驱动因素不重叠。事实上,在大多数情况下,针对特定于儿童癌症分子变化的治疗方法尚未开发,因此儿童癌症领域必须依赖针对成人适应症的靶向药物。
在对生物标志物和肿瘤生物学理解方面取得的最新进展,加上对“安静”基因组的认知和融合蛋白在儿童癌症中的重要性,强调了采用以儿童为中心、作用机制驱动的方法对儿童肿瘤药物开发的价值,《儿童加速治愈和公平研究(RACE)法案》是一个重要的全球催化剂,我们在之前的博文中对此进行了讨论。
儿童癌症药物发现和开发的未来考虑因素
目前,只有有限数量的靶向治疗药物获得了监管部门的批准或在儿童肿瘤学中广泛使用。鉴于儿童恶性肿瘤药物开发的复杂途径和最新监管变化,多种药物引起了人们的兴趣,目前正在研究中。
虽然目前大多数获批的儿童癌症靶向治疗药物是激酶抑制剂,但正在研究更广泛的其他靶点药物,包括:
- 表观遗传修饰物
- 抗凋亡蛋白
- 针对细胞表面蛋白的免疫疗法。
直接靶向非激酶癌蛋白(儿童癌症中最常见的致癌驱动因素之一)的新药物策略已在临床前研究中显示具有一定的前景,并已进入临床研究阶段。
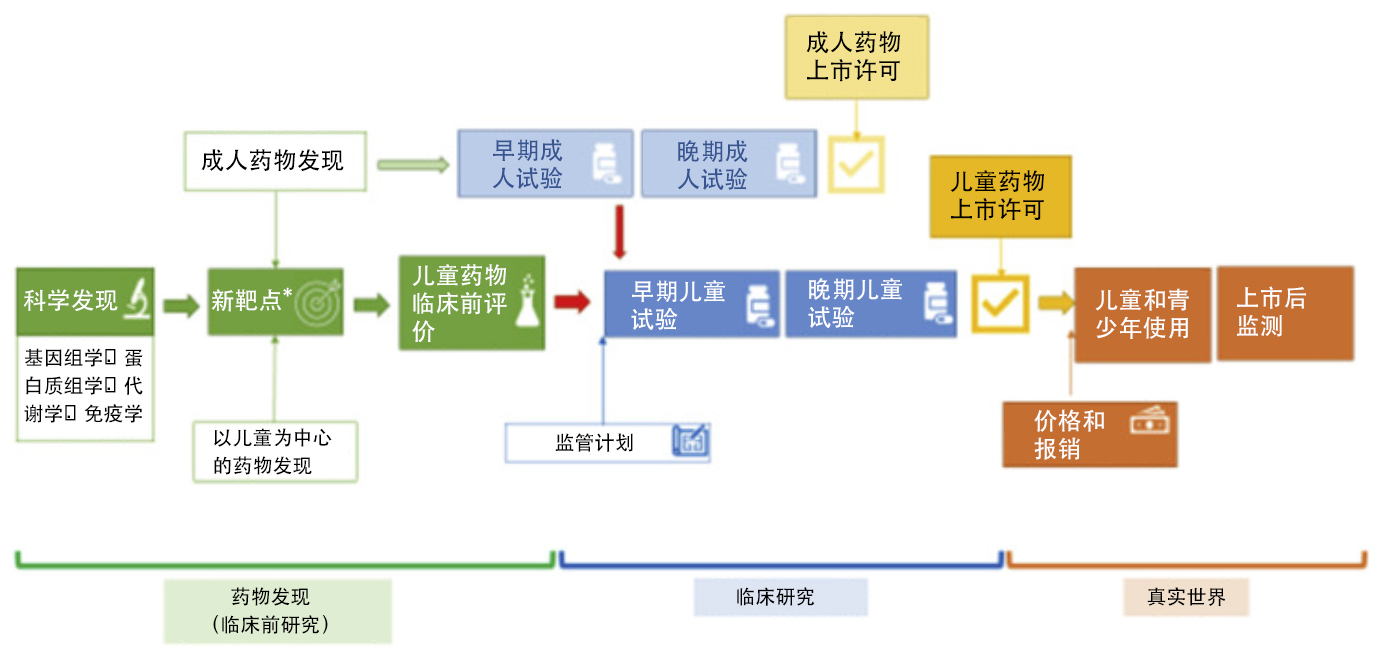
儿童恶性肿瘤药物开发途径。来源:ACCELERAT – Five years accelerating cancer drug development for children and adolescents, Eur J Cancer 2022 May;166:145-164.
儿童肿瘤药物开发面临若干挑战,包括与成人肿瘤相比患者数量较少、基因组普遍安静,以及需要制定针对非激酶融合癌蛋白的策略。然而,这些相同的挑战带来了一些机遇,包括授权跨国家边界和申办方协调药物开发、更易识别儿童癌症的真正致癌驱动因素以及降低获得性耐药性。
利用类器官和其他新型体外解决方案
随着新疗法进入临床,开发一些方法来评估有质量保证的初始临床前测试非常重要,以评估新的分子靶向化合物。这可以在一系列充分表征的模型中完成,从而为提高这些药物在治疗儿童恶性肿瘤方面的成功率奠定基础。
总体而言,由于这些肿瘤在遗传上远不如成人肿瘤复杂,因此预计将更容易鉴别强大的预测性生物标志物,以便准确匹配靶标和药物。根据鼓励在药物开发过程中使用体外试验来检测化合物的FDA现代化法案2.0,冠科生物开发的肿瘤类器官(OrganoidBaseTM)适用于基因编辑和高通量药物筛选,并提供独特的机会来扩展来自罕见癌症的肿瘤组织,同时保持原始患者肿瘤的分子和结构特征,模拟人类肿瘤的异质性、分子/遗传复杂性和肿瘤微环境(TME)。
类器官平台有望为加速深度癌症研究、药物筛选、个性化医疗做出重大贡献,并促进对患者肿瘤的单药治疗和联合用药应答情况进行评估,以及在药物发现早期鉴别潜在的生物标志物。
儿童癌症类器官已证明,使用这些模型来捕获疾病和组织异质性具有可行性,而 EVPT 平台保存了具有内源性免疫细胞、成纤维细胞和其他基质成分的自然TME。综上所述,这些技术均证明了良好的互补性,以及使用这些模型来捕获疾病和组织异质性的可行性。
类器官技术平台为确定治疗高危患者的新方法和改善儿童癌症治疗提供了独特的工具箱。有关这些技术的更多信息,请参见此处。






