为什么对儿童的癌症治疗落后于临床肿瘤学的最新进展?中美冠科总监Mike Baty深入研究了儿科癌症,以及最近的法规变化和其他研究重点将如何为儿童提供新的治疗方法。
全球每年约有40万儿童(从婴儿到青少年)被诊断出患有癌症。儿科癌症通常采用最初在几十年前获批的毒性化学疗法治疗,该疗法可能在以后的生活中产生严重副作用,包括继发性癌症。不幸的是,儿童获得新疗法的途径有限,成人的新药通常仅在获得批准后多年才可在儿童中进行测试。
为什么儿科癌症用药一直是制药公司的低优先事项
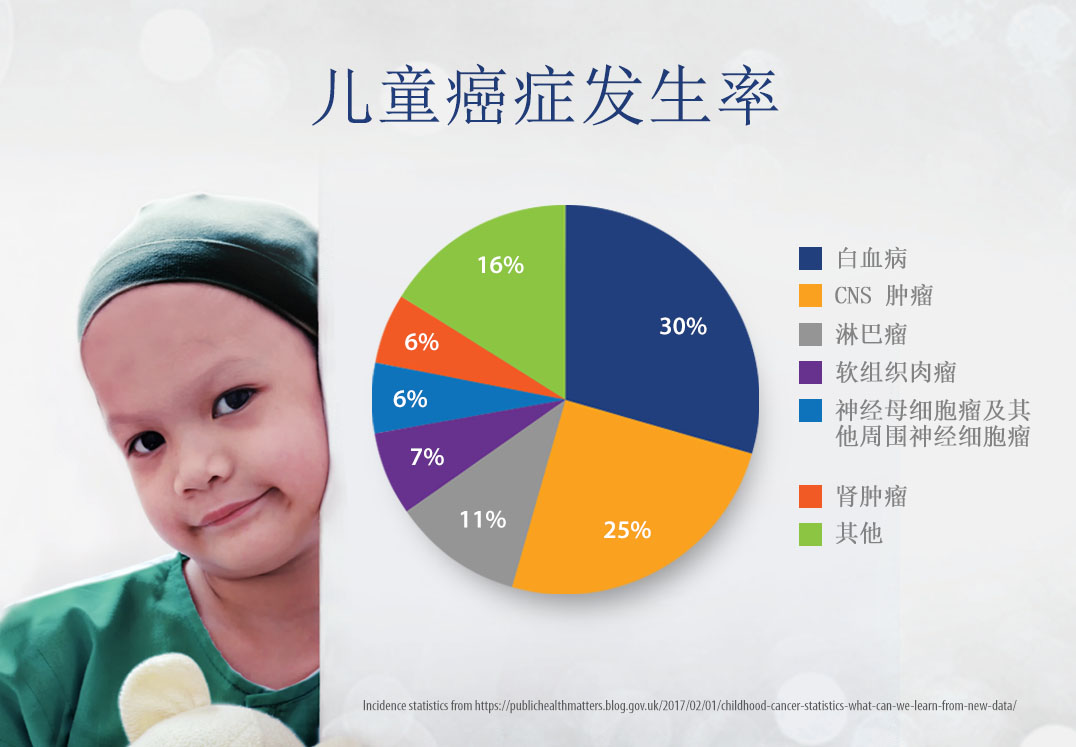
白血病(急性淋巴母细胞白血病和急性髓系白血病)是儿科癌症的最常见类型,约占所有病例的30%。脑和脊髓肿瘤约占25%,神经母细胞瘤、肾母细胞瘤和淋巴瘤分别约占6%。
自1995年以来,在经过FDA批准的180多种癌症药物中,仅14种被批准用于儿童患者,另有26种已在标签外使用(即:以许可证中未描述的方式使用),仅3种药物被批准专用于儿童。
由于科学障碍、额外的监管负担和财务诱因等因素,儿科癌症用药一直是制药公司的低优先事项。儿科癌症被归类为“孤儿病”,约占美国所有癌症的1%。此外,由于该类疾病的罕见性,获得患者和进行监管批准所需的临床研究可能极具挑战性。
不断变化的监管格局
美国和欧盟的监管机构已试图通过一系列立法举措来鼓励儿科癌症药物的开发,其中包括:
- 《儿科研究公平法》(PREA)(美国)
- 孤儿药认定计划(美国和欧盟)
- 《创造希望法案》(美国)
- 市场独占权(EU)
- 支持儿童用药物开发的行动计划(欧盟)
然而,直到最近,美国的制药公司才能够申请孤儿豁免,并且无需制定儿童计划即可开发出成人癌症用药物。2020年8月,美国通过了新的立法,有望对公司开发儿童药物的方式产生重大影响。《儿童加速治愈和公平研究(RACE)法案》是对先前法规的重大更新,该法规取消了孤儿豁免,并要求对儿童模型进行测试,以便能够提交无论是用于儿童还是成人的新癌症治疗药物。
FDA关于RACE法案的咨询委员会指出:“作为整体药物开发计划的一部分,儿童肿瘤药物开发应与成人肿瘤药物开发相协调”。
“作为整体药物开发计划的一部分,儿童肿瘤药物开发应与成人肿瘤药物开发相协调”。
-FDA关于RACE法案的咨询委员会
重要的是,这将在药物开发计划中重点关注儿科药物开发,并且将要求每项计划均考虑儿科癌症,并制定初步的儿科研究计划。此外,FDA还建立了儿科分子靶点清单,确定了150多个相关靶点,其中一些既发生在成人疾病中,也出现在儿科疾病中。希望这将鼓励药物开发人员考虑将其疗法用于儿科的潜力。
对相关模型日益增长的需求
随着商业研究愈发关注儿童癌症,为测试新型药物的使用情况,对建立和验证相关、可靠且可临床转化的临床前模型的需求日益增长。当前,缺乏代表儿科癌症谱的商用平台,例如细胞系模型、类器官模型和可靠的患者源异种移植模型。现在,药物开发人员的首要任务是使用此类模型,以便进一步研究,并为测试新疗法提供平台,以对抗这一毁灭性疾病。
总之,这些变化将为癌症儿童带来新的希望,并有助于确保其能够获得更安全、更有针对性的治疗方法,并降低长期副作用的风险。