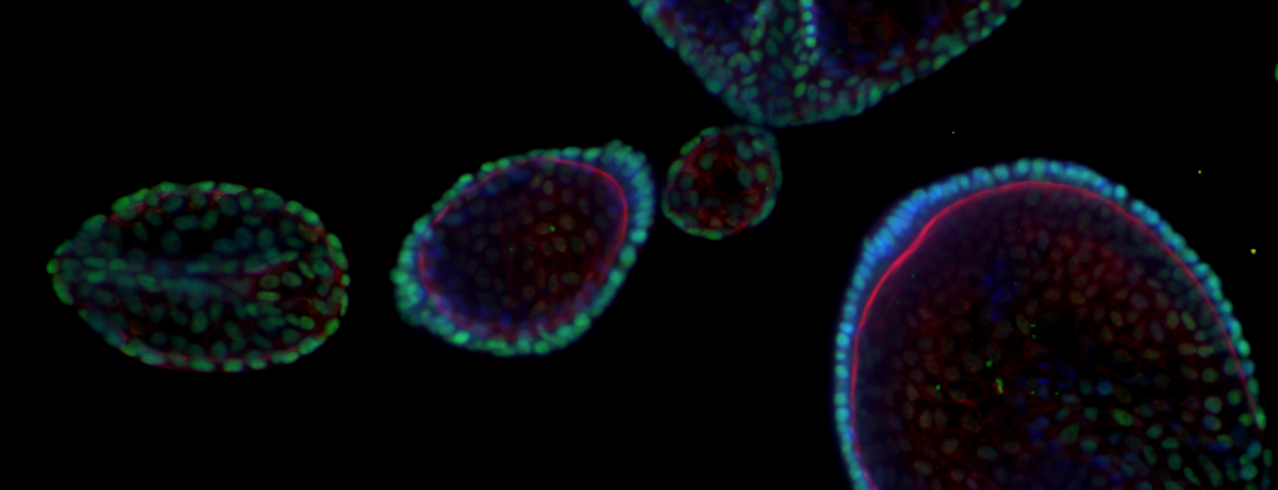
抗癌药物的药物损耗率远高于其他类别的治疗药物。估计只有 5% 的抗癌药物能够进入临床阶段,其中部分原因是临床前数据的转化性差。
长久以来,制药行业一直采用 2D 肿瘤细胞系进行体外抗癌药物筛选。尽管该系统的用途很多,但研究人员发现利用其得出的临床前结果与临床结果之间的相关性不强。目前亟需探索更先进的临床前模型,从药物发现的初期阶段(即高通量药物筛选[HTS])去更准确地反映人类癌症的复杂性,从而让研究人员尽早做出合理的决策。患者来源类器官(PDO)和患者来源异种移植(PDX)演变出的类器官(PDXO)都 是代表性的肿瘤生物学体外模型,成为构建涵盖广泛癌症适应症、亚型和基因型的生物样本库的有力工具。
本文重点介绍了具有高度临床相关性、患者相关性的肿瘤类器官对 HTS 的价值。它们是具有更好转化性和预测性的先进模型。下面,本文将通过一个案例研究来展示即用型(AR)类器官平台的功能,该平台具有以下几个优势:
- 大幅节省时间;
- 单个批次类器官可进行重复试验;以及
- 适用于 HTS 和广泛的平台评估。
肿瘤类器官的价值
如前所述,肿瘤类器官是 3D 体外模型,高度重现了原发肿瘤的表型、基因型和形态学(3D 结构)特征,这些特征都是影响药物反应的重要因素。它们具有可扩展性、高度的临床预测性,即使经过长期培养和冻存后仍能保持基因型和表型的稳定性。
使用Hubrecht 类器官技术(HUB)方案开发的肿瘤类器官可以保留肿瘤干细胞(CSC)成分,因此可以长期繁殖,甚至可以冻存供后续研究使用,即使经过多次传代仍能够将原代肿瘤的表型和基因型特征(包括结构和细胞异质性和体细胞突变)保留下来。
肿瘤类器官可以直接从患者肿瘤组织(PDO)或PDX(PDXO)中提取,后者可以从大型、经验证和注释的模型库购买,具有以下几个关键特征:
- 捕捉患者群体的异质性,包括不同的基因背景;
- 涵盖广泛的适应症;
- 支持大规模研究,例如 HTS,以及
- 确保重复研究的可用性。
PDX 和 PDXO具有生物学等效性,能够精准模拟患者体内环境,因而成为了反映患者原代细胞特征的模型。这两种模型都是专门使用 HUB 方案开发的,为抗癌药物的发现开拓了广阔的新视角。
大型类器官平台可以同时使用多个具有患者相关性的模型,颠覆了早期传统的药物发现方法:针对性选择合适的 PDO/PDXO 模型,进行“培养皿中的临床试验”。此类模型库不仅反映了个体患者的特征,还反映了患者群体水平的特征。患者间和肿瘤内异质性是临床中产生耐药性的常见原因。可以在大量模型上同时筛选化合物,从而可以更快地决定要开发哪种先导化合物。在药物发现中,利用大型类器官平台并结合生物标志物分析可以识别有反应的癌症亚型和基因型,从而可以对患者进行早期分层。
案例研究:具有稳健性、重现性和临床相关性的泛癌即用型类器官药物筛选
本研究比较了生物库(冷冻保存)的 PDXO(AR 类器官平台)与新鲜制备的患者来源肿瘤类器官(传统方法)的性能。
AR 平台选出了 50个 PDO/PDXO 模型作为代表,分别选自7种肿瘤类型(结直肠癌、乳腺癌、肺癌、胰腺癌、卵巢癌、宫颈癌和黑色素瘤),另外还有若干(已配对)健康组织(对照)样本(图1A)。研究目的是产生一个异质群体,以代表亚型和驱动基因突变的显著变异,如整个样本中 KRAS 突变的多样性(图1B)。采用传统方法制备了 14个模型,代表了一些肿瘤适应症(未显示)。为了提高一致性,所有程序均为标准化操作流程,并使用了自动液体处理设备。
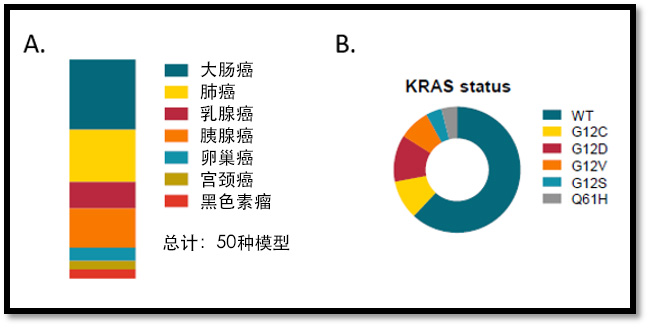
图1: (A)AR类器官平台的 50个 PDXO 代表的肿瘤类型,(B)整个 PDXO 的 KRAS 突变状态
评估了用这两种方法检测的PDO/PDXO模型的增殖和药物反应。通过重复药物敏感性试验评估类器官性能,评估平台内和平台间变异性、CV、Z 因子、检测窗口和 IC50 值。使用细胞滴度 Glo(CTG,相对于对照组的细胞活力)和高内涵成像(HCI)读数(每个类器官的平均细胞核数,相对于对照组)测定类器官药物反应。
首先比较了代表 AR 类器官平台中所有肿瘤适应症的 14种类器官模型在基于 CTG 的药物筛选分析中的检测性能。总体而言,传统模型和 AR 模型均表现出高度的重现性,具有相似的高Z因子、低平台内和平台间变异系数(CV)(<15%)以及大检测窗口(阴性对照/阳性对照)(图 2)。与传统模型(数据未显示)相比,AR 平台显著降低了成本,并将项目周期(从启动到数据交付)从几个月缩短至几周(>6倍)。
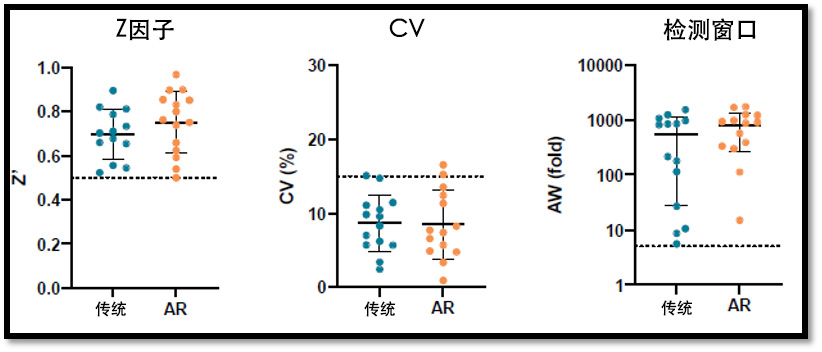
图2: AR类器官平台与传统方法的比较
AR 平台和传统方法在 CTG 和 HCI 检测中得出了相似的结果。如图 3所示的各代表性曲线图,比较了采用传统方法(3A 和 3C)和 AR 平台(3B 和 3D)培养的细胞对紫杉醇、卡铂和顺铂的药物反应。
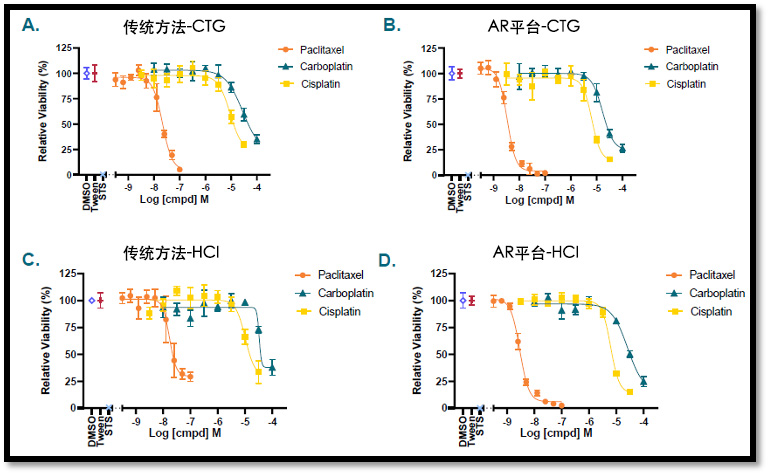
图3: 比较AR类器官平台与传统方法的药物反应(所有检测的 n = 4;对数据进行了溶媒对照归一化处理)
如表 1所示,采用传统方法和 AR 方法培养的受试卵巢类器官模型(OV5296B)获得了高度相似的 IC50(µM)值。利用 GraphPad Prism 绘制中的可变斜率(四参数)拟合曲线反映了两种方法进行CTG和HCI检测所获得的数据相当。这种相似性在另外 23个模型中的得到验证,模型涵盖具有不同基因背景的七个适应症的子集(数据未显示)。两个平台得出的IC50数据是一致的,即使在间隔数月或在不同的冠科生物试验地点进行检测时也得出了同样的结论。(数据未显示)
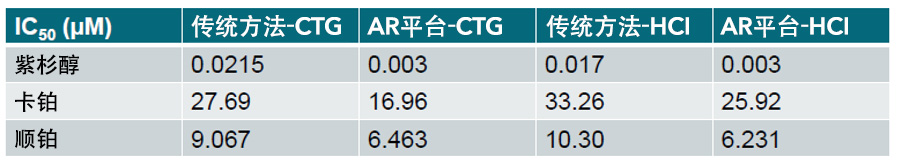
表1:传统模型和 AR 模型以及 CTG 和 HCI 检测方法的 IC50(uM)值
在数周的实验中,分别采用传统方法与 AR 方法培养结直肠肿瘤 PDXO(CR5043B)模型,评估两种方法培养的模型对 SN38 的药物敏感性(CTG 检测,n = 4)(图 4A)。采用传统方法对 CR5043B 进行增殖,传代超过 10次,并在四个不同的传代节点(p19、p20、p21、p29)检测模型的药物反应。药物反应曲线显示高度重叠,表明 IC50 值相似(CTG 检测,n = 4)(图 4B)。
在不同地点(冠科生物 Leiden 和 Utrecht)使用不同的液体处理系统对 AR 结直肠肿瘤类器官(P18T)进行接种。通过 HCI 检测(n = 4)测定模型对 5-氟尿嘧啶(5-FU)的药物反应。这些实验中曲线形状和位置的相似性,表明测定结果具有实验间重现性(图 4C)。
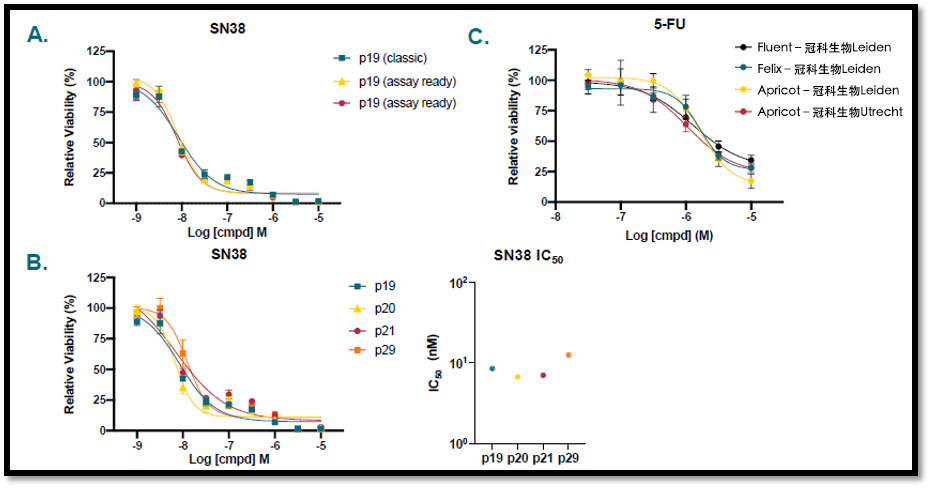
图4: AR类器官平台与传统方法在不同检测中的药物敏感性
总体而言,两个系统都表现良好。但是,AR 类器官平台可以显著缩短用户的时间和成本,最大限度地降低安排协调方面的难度,同时能够用于筛选大型肿瘤类器官平台。该案例研究突显了 AR 平台能够有效地区分敏感、部分敏感和不敏感模型,展现了类器官在患者分层方面的优势。
结论
抗癌新药发现方法成本高、风险大、速度慢、效率低。而选择具有更高临床相关性且更适合 HTS 的模型可以彻底改变这一局面。
相较于 HTS 中常用的传统 2D 细胞培养系统,患者来源的类器官是一种具有更强患者相关性的体外平台。3D 体外肿瘤模型忠实地再现了原代肿瘤细胞的基因组、形态学和病理生理学特征;因此,在体内评估之前利用患者来源的类器官进行临床前药物筛选提供了一个快速、可扩展的转化平台。经验证,即使经过长期培养和冷冻保存,这些模型仍能够保持基因型和表型的稳定性。
要实现基于类器官的 HTS,需要用几个关键组成部分构建一个平台,该平台可以最大限度地提高选择具有高转化性和临床成功率的候选药物的机会。此外,AR类器官平台可以显著节省时间和成本。由于大多数可用的 PDO/PDXO 模型也可用作 PDX,研究人员可以直接获得反应灵敏的体内匹配模型,这些模型可以互补使用,以实现从早期体外研究到后期基于动物的验证试验的有效过渡。
利用 OrganoidBaseTM将抗癌药物发现提升至新的高度。由于具有更好的转化性和预测性,类器官平台具有诸多显著优势,包括节省时间,单个批次可进行重复试验,支持高通量药物筛选。即刻了解 OrganoidBaseTM,充分释放肿瘤类器官在研究中的应用潜能。