在这篇文章中,我们探讨了几个评估抗PD-1(程序性死亡受体1) 检查点抑制剂功能的体外效力的实验,主要用于测试抗PD-1药物的 T 细胞反应。
在这篇文章中,我们探讨了几个评估抗PD-1(程序性死亡受体1) 检查点抑制剂功能的体外效力的实验,主要用于测试抗PD-1药物的 T 细胞反应。
抗 PD-1 药物在癌症领域的持续成功,加之关键专利预计在未来几年即将到期,引发了众多公司对开发抗 PD-1 生物仿制药的兴趣。
开发抗 PD-1 药物的一个关键步骤是全面表征它们的功能性,例如证明它们能够增强 T 细胞反应和产生细胞因子的能力,同时表明它们不会诱导体外抗体依赖性细胞介导或补体依赖性细胞毒性。
抗 PD-1 药物的成功
2014 年,随着单克隆抗体 (mAb) 派姆单抗 (Keytruda,K药) 和纳武单抗 (Opdivo, O药) 的批准,抗 PD-1 药物在治疗癌症方面取得了惊人的成功。这些免疫肿瘤学 (I/O) 药物现已被批准用于多种癌症类型,且它们的作用机制已被公认为癌症免疫治疗的强大策略。鉴于它们在市场上取得的巨大成功和持续增长,全球生物医药公司都在竞相开发抗 PD-1 生物仿制药,以期关键专利到期也就不足为奇了。
如下图所示,抗 PD-1 药物通过激活 T 细胞起作用。他们主要通过阻断T 细胞活化的主要负调节因子,T 细胞表面受体“PD-1”(也称为 CD279),来实现这一点。
抗体阻断免疫检查点的分子机制示意图。 T细胞上的PD-1和肿瘤细胞上的PD-L1之间的相互结合作用抑制了T细胞的活化。 用于癌症免疫治疗的抗体药物与 PD-1 或 PD-L1 结合,阻断 PD-1/PD-L1 相互作用。
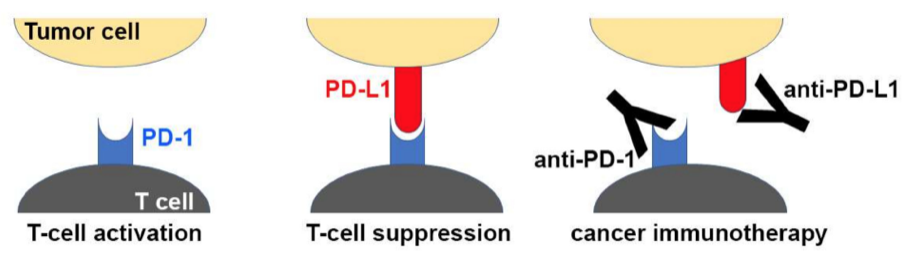
Adapted from Lee et. al. (2019). Molecular Interactions of Antibody Drugs Targeting PD-1, PD-L1, and CTLA-4 in Immuno-Oncology. Molecules. 24, 1190; doi:10.3390/molecules24061190. Used under Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).
PD-1 与其相关的程序性细胞死亡配体 PD-L1 和 PD-L2 相互作用。这些配体通常在抗原呈递细胞 (APC) 如树突状细胞 (DC) 上表达。
癌细胞经常利用 PD-1/PD-L1 通路的这种免疫抑制机制来发挥自身的优势,并逃避 T 细胞的免疫监视。 目前已发现 PD-L1 在不同癌症类型细胞的表面的过表达,包括乳腺癌、肺癌、膀胱癌、淋巴瘤、胶质母细胞瘤和黑色素瘤。 因此,在肿瘤微环境 (TME) 中,过表达的 PD-L1 与 PD-1 结合并抑制 T 细胞介导的抗肿瘤免疫反应,从而支持肿瘤细胞的存活和扩增。
用于支持抗 PD-1 生物仿制药开发的体外检测实验
与使用替代测量相反的是,抗 PD-1 生物仿制药的开发需要证明其功能性。 目前有很多经过验证的功能性试验来测试它们的体外表征情况,例如比较克隆之间的差异或与FDA批准的参考产品(例如,K药和O药)相比较的效力。 本节提供了这些检测方法的摘要,其中一些已在癌症免疫治疗学会会议上进行了相关介绍。
PD-1/PD-L1 阻断试验
PD-1/PD-L1 阻断试验可用于确认生物仿制药与参考产品之间是否具有相同的作用机制 (MoA)、效力和稳定性。
有两种不同的基因工程细胞系用于 PD-1/PD-L1 阻断试验:
- 稳定表达 PD-1、TCR 和信号(例如荧光素酶)的效应细胞(例如 Jurkat、Raji)
- 表达 PD-L1 的抗原呈递细胞(例如 Raji、CHO)
两种细胞系的共培养使 PD-L1 与 PD-1 结合并抑制效应细胞中的 TCR 信号传导。由于信号报告系统通常由荧光素酶基因上游的 NFAT 响应元件 (RE) 组成,TCR 信号的缺失会阻止荧光素酶表达。
在存在 PD-1/PD-L1 抑制剂的情况下,会产生可检测和量化的生物发光信号。通过抑制剂的连续稀释可以评估其效力,而在不同的温度和/或时间长度下保存测试品可评估其稳定性。体外 PD-1/PD-L1 阻断试验也可用于人类靶标表达平台(例如 HuCELL™),其中小鼠肿瘤细胞被设计表达人源化免疫肿瘤学靶标,包括 PD-1。
同种异体混合淋巴细胞反应 (MLR) 检测
同种异体 MLR 测定也是一种共培养测定,允许测量 树突细胞DC 介导的 T 细胞活化。 响应细胞(例如 CD4+ T 细胞)和刺激细胞(例如单核细胞衍生的 DC 或外周血单核细胞 [PBMC])必须来自不同的供体,因为 T 细胞激活是基于同种异体免疫反应。
同种异体 MLR 可与流式细胞分析、ELISA 或其他基于微孔板的读数结合使用,以测量细胞因子的产生或细胞增殖。
超级抗原葡萄球菌肠毒素 B (SEB) 刺激PBMC
在该试验中,T 细胞活化通过暴露于特定抗原(例如葡萄球菌肠毒素 B (SEB))来测定。 SEB 是一种细菌毒素,能够与抗原呈递细胞 (APC) 和 TCR 上的 MHC II 类分子结合,诱导促炎细胞因子的释放,例如 IL-2、IL-6、TNF-α 和 干扰素-γ。
PBMC 或全血可用于抗原刺激,然后用 ELISA 或流式细胞分析来定量细胞因子的释放。基于流式细胞分析的细胞计数微珠阵列可用于同时检测多种细胞因子,使用 CFSE 或类似染料的预标记样品可用于测量 T 细胞增殖。 监测 T 细胞反应的方法还包括通过 Luminex® 和 MSD S600 以及常规ELISA ,对细胞因子和趋化因子进行分析。
抗原特异性 T 细胞召回和激活试验
除了增强 T 细胞活化和增殖外,PD-1的阻断也已被证明可诱导记忆 T 细胞的形成,有助于其抗肿瘤活性。这种现象可以在体外使用抗原召回和激活试验进行监测。简单的来说,从先前有过病毒或细菌抗原暴露的个体中获得新鲜的 PBMC,并在再次接触抗原后测量记忆 T 细胞的扩增。
基于巨细胞病毒 (CMV) 的召回和激活是比较常规的检测手段。在这种类型的检测中,在有无PD -1 抗体存在的情况下,分离来自 CMV 血清阳性患者的 PBMC 并用 CMV pp65 蛋白库(即来自人 CMV 的 65kDa 磷蛋白 (pp65) 的肽混合物)刺激多天。然后使用 CMVpp65-四聚体捕获 CMVpp65 特异性 CD8+ T 细胞以进行流式细胞分析,以评估该亚群是否因 PD-1 抑制而发生扩增。召回分析试验还可以单独或结合形式使用其他毒素(例如,破伤风毒素)或其他病毒抗原(例如,爱泼斯坦 – 巴尔病毒,流感)。
Treg 介导的 T 细胞抑制试验
免疫检查点抑制剂的成功,凸显了在 T 细胞活化和抑制肿瘤细胞消除之间保持平衡的重要性。在细胞水平上,调节性 T 细胞 (Tregs) 通过抑制效应 T 细胞功能来帮助平衡免疫反应。肿瘤 TME 内效应 T 细胞和 Treg 的比例已被证明是患者预后和对检查点抑制剂治疗反应的重要预测因子。
PD-1 在 Treg 的一个亚型上表达, PD-1 阻断可以消除其抑制作用或可能导致 Treg 的扩张甚至疾病进展。鉴于PD-1 和 Treg 之间的生物学意义非常复杂,监测 Treg 功能的分析将有助于阐明新型抗 PD-1 分子对 Treg 功能的影响。
Treg 抑制测定设置涉及两种不同细胞群(Treg 和响应细胞,如 CD4+ T 细胞)的共培养。可以使用抗 CD3/抗 CD28 珠子诱导 T 细胞活化,然后用测试品或参考化合物进行处理,通过增殖测定(CFSE,[H3] 胸腺嘧啶)或流式细胞术进行的标记分析获得各种抑制率读数。
建立 Treg 抑制试验时需要考虑几个因素。由于 Tregs:T 效应细胞的比例在免疫调节中至关重要,因此以不同的比例共培养 Tregs 和反应细胞以准确评估抗 PD-1 药物如何影响 Treg 功能非常重要。
此外,所使用的 Treg 类型可能很重要,诱导 Treg (iTreg) 一般更适合肿瘤细胞研究。最后,需要优化实验的刺激条件,以便能够可靠地检测到 Treg 功能。
抗体依赖性细胞介导的细胞毒性 (ADCC) 检测
ADCC 是几种单克隆抗体 (mAb) 疗法的重要作用模式,由免疫(例如 NK 细胞)识别 Fc 区介导,导致细胞裂解和死亡。然而,由于 PD-1 在其他免疫细胞上表达,目前批准的抗 PD-1 生物制剂属于 IgG4 或 IgG1型,以预防 ADCC 并将毒性风险降至最低。因此,对于抗 PD-1 生物仿制药,ADCC 检测用于确认它们没有 ADCC相关的 MoA。
在经典的 ADCC 检测中,原代细胞(包含 NK 细胞或纯化的 NK 细胞的供体 PBMC)与表达目标抗原的靶细胞混合并暴露于待测 mAb。根据所使用的方案,可使用放射性或非放射性释放测定法或通过基于荧光染料的流式细胞术分析,区分目标和效应细胞群或活细胞和死细胞,从而测量细胞毒性。此外,还可以使用表达 NFAT-RE 诱导的荧光素酶信号工程效应细胞系。后者可消除与原代细胞相关的变异性,并输出具有高信号和低背景的读出信号。一般建议使用与各种细胞死亡读数(包括高内涵成像 (HCI)、LDH 释放和流式细胞分析)都兼容的细胞,例如 PBMC/NK。
T 细胞介导的肿瘤杀伤试验
肿瘤细胞与自体或非自体免疫细胞的共培养,对于监测免疫介导的肿瘤杀伤非常重要。常见的读数是 HCI、LDH 释放、流式细胞分析、实时成像和细胞因子释放分析。虽然自体系统是理想的,但这种方法存在一些公认的挑战,比如来自供体癌症患者的血液量有限,大多数供体患者的 PBMC 中缺乏肿瘤反应性 T 细胞,以及药物开发应用的可扩展性有限。另一方面,非自体 PBMC 能够实现更高的通量和多模型筛选,但公认的局限性是它们不能用于测试在临床环境中观察到的抗原特异性。
为了增强共培养肿瘤检测的临床相关性,肿瘤类器官模型被越来越多的使用。肿瘤类器官是先进的 3D 培养模型,彻底改变了肿瘤学研究领域。它们保留了原始患者肿瘤的许多基因组、形态学和生理学特征,与传统的 2D 细胞培养物相比,它们具有卓越的临床相关性、患者多样性和对药物反应的预测性。此外,它们还具有高度可扩展性,提供几乎无限的患者材料来源,并具有与自体或非自体免疫细胞共培养的能力。在一些情况下,还可以使用包含荧光素酶标记的肿瘤类器官与非自体同种异体反应性 T 细胞的共培养系统,以测量 PD-1 阻断对 T 细胞介导的肿瘤类器官杀伤的影响。
结论
免疫检查点调节剂改变了癌症治疗领域。 随着几项关键专利将在未来几年到期,药物开发商正积极寻求通过生物仿制药进入市场。 这增加了对生物仿制药进行功能表征的体外分析需求。 正如本文所总结的,有多种体外效力试验测定可用于评估抗 PD-1 检查点抑制剂的功能。
在体外表征之后,需要体内模型来推进最有希望的候选物的开发。 经验证的体内人源化免疫肿瘤学模型,以免疫肿瘤学应用的人类靶标表达为特征,包括 CD34+ 和 PBMC 人源化小鼠以及 HuGeMMTM 模型,可用于解决广泛的科学问题。
了解更多关于 CrownBio 如何帮助您开发抗 PD-1 生物仿制药和人源化靶标项目了解更多:人源化PD-1敲入小鼠 | 免疫肿瘤学|冠科生物