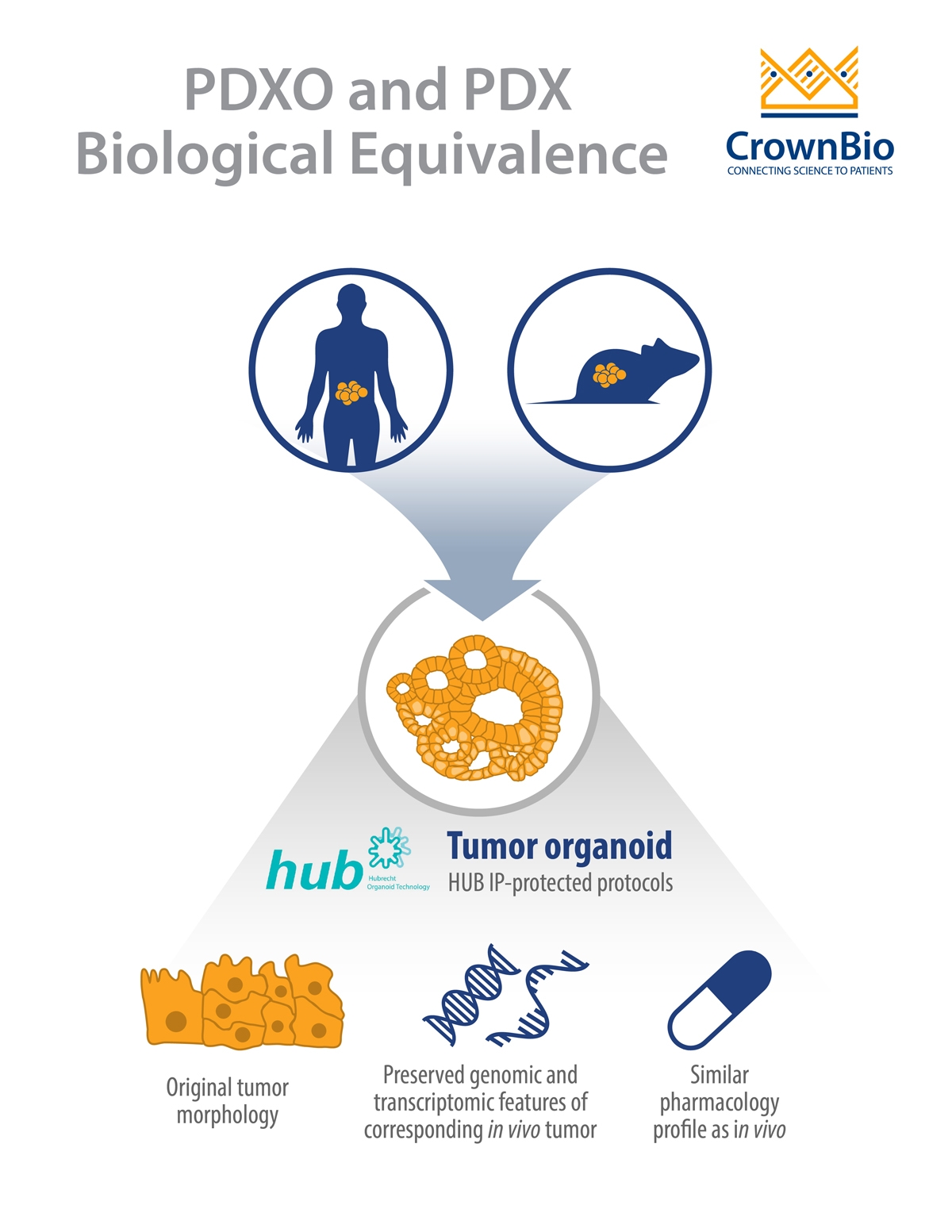
基于共享的基因组多样性、肿瘤异质性、组织病理学和药物应答特征,了解人源肿瘤异体移植模型(PDX)和人源肿瘤异体移植模型来源的肿瘤类器官(PDXO)之间的生物等效性。探索上举共享特征是如何使两种模型得以高度互补并可互换使用,为研究者同时提供具有患者相关性的体外PDXO系统以及与之相匹配的高预测性体内PDX平台。
PDO、PDX和PDXO均为人源模型
癌症是一种异质性疾病,普遍认为癌症干细胞驱动了癌症的形成和进展。由于这种干细胞成分的存在,因此可以移取患者肿瘤并置于以下系统中进行增殖:
- 植入免疫缺陷小鼠体内,生成人源肿瘤异体移植(PDX)体内模型。
- 使用Hubrecht Organoid Technology(HUB)开发的方案,置于三维(3D)系统中培养,生成人源肿瘤类器官(PDO)。
两种情况下的人源模型均保持了患者原始肿瘤的形态学和基因组特征。
此外,小鼠传代人源肿瘤(即PDX模型)可作为癌症干细胞来源,同样采用HUB方案,生成PDX来源的肿瘤类器官(PDXO)。这种方法由于提供了与原始患者高度相关的体外/体内匹配模型,因此尤其引人注目。
如此的匹配平台前所未有,为体外研究向体内研究的有力过渡提供了机会。大规模的匹配模型库可代替患者人群进行临床前药理学研究,更好地预测临床应答。
PDXO与相应PDX匹配模型具有生物等效性
在今年的AACR年会上,我们首次展示了用我们自己的大型PDX模型库开发出来的PDX来源肿瘤类器官。1925号海报详细描述了用结直肠、肺、胃和头颈部PDX原代肿瘤开发的第一阶段PDXO情况。目前,我们已经将其扩展到超过10种不同类型的癌症,并在本周波士顿举行的AACR-NCI-EORTC会议上展示了新的PDXO数据 。
研究显示,PDX来源的肿瘤类器官由于在一些特征上与相应的PDX匹配模型相同,因此与PDX匹配模型具有生物等效性。PDXO样品的组织病理学分析显示,PDXO与原始PDX肿瘤的结构一致,并且在PDXO的早期和晚期传代中,形态学也保持一致。
RNAseq分析显示,PDXO与其PDX匹配模型的mRNA表达相关性>96%,突变一致性>94%。该结果与 HUB和Clevers团队先前报告的比较PDO和患者肿瘤数据的结果一致。
此外,还评估了PDXO和PDX匹配模型对标准治疗药物的应答情况。初步数据显示,PDXO离体药物敏感性IC50数据集中,大部分数据(81%,26/32)与PDX体内药物敏感性肿瘤生长抑制数据相关。
这两个模型间的生物等效性表明,PDXO保留了许多PDX匹配模型的关键临床相关特征,因此PDXO是具有临床相关性的体外模型。该情况与PDO相似,PDO也保留了人源肿瘤的许多特征,并可 预测患者的临床应答。
上述结果证明,类器官技术能够忠实有效地将人源体内生物学复制到体外,从而为高通量筛选和大规模人群研究(预测患者的临床药物应答)提供了平台。
PDXO体外系统与PDX体内平台互补
人源肿瘤异体移植模型(PDX)是可高预测性评价治疗反应的临床前模型。在类II期小鼠临床试验 中广泛使用,可有效模拟人类临床试验中观察到的固有多样性和异质性。
然而,PDX模型在开展高通量药物筛选或测试各种药物剂量或组合的效果方面不甚理想。针对这些需求,体外类器官系统更为合适。并且,使用体外类器官系统有机会限制、优化和改善动物模型的使用,符合3R原则。PDX/PDXO匹配模型既保留患者特征,又可跨多项研究忠实传代使用,有了这一模型,便为体外向体内的有力过渡搭建了一个开创性客制化平台。
此外,PDXO非常方便进行体外操作,这一点克服了PDX的共同限制,是一个极具吸引力的特征,由此方便了采用可进行靶向基因组编辑的技术(如CRISPR),方便了对模型进行生物发光标记,以及引入基质细胞(如肿瘤类器官和免疫细胞共培养)。因为建立和维护PDXO所需的时间和资源较少,PDXO也更具成本效益。总的来说,无论是体外还是体内,均可以更快地构建出更具专属性的客制化肿瘤模型。
结论
PDX来源的肿瘤类器官系统和PDX系统之间存在独一无二的生物等效性和互补性,为癌症转化研究和药物发现提供了一个开创性平台。研究者通过使用相匹配的PDXO和PDX系统,可在基因组多样性和异质性等效的同一个患者匹配模型中,迅速地从体外筛选系统过渡到体内药理学。最大限度地利用我们的PDX模型,得到大型匹配模型库,可进行替代性患者人群研究,以更好地预测临床应答。