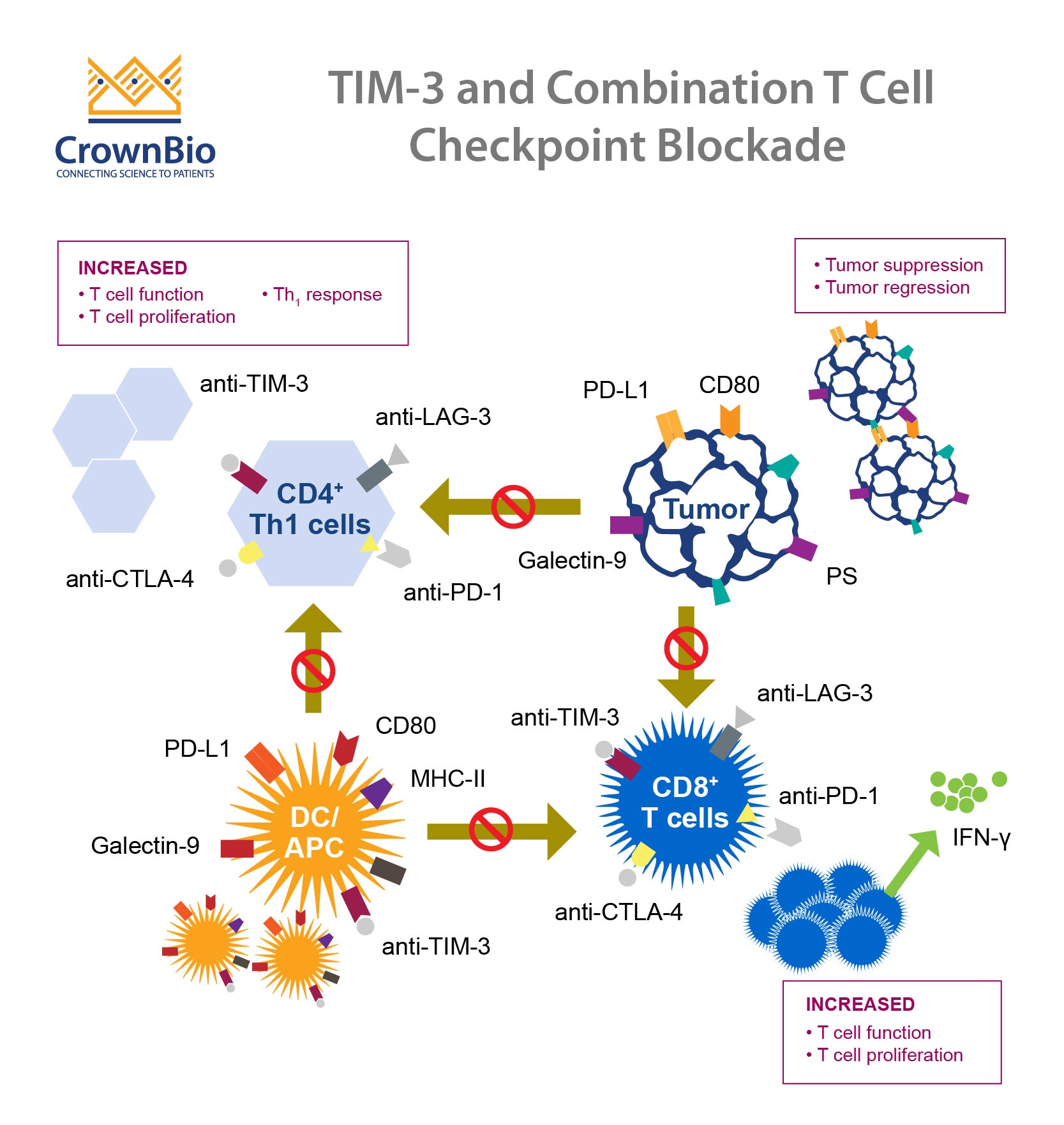
与负调节器 PD-1 与 CTLA-4 不同,研究员正在了解 TIM-3 的功用以及它能够扮演的脚色。
TIM 蛋白家族与细胞凋亡息息相关
TIM 蛋白家族是由三种 (hTIM1、3、4) 人类身上与八种 (mTIM1-8) 老鼠上的因子组成的, TIM 蛋白是由信号序列、细胞外 IgV 域、黏液素域、跨膜域、以及细胞内胞质尾区组成的第二型细胞表面糖蛋白。
所有成员皆在 IgV 域内保有同源性,而其他的区域则没有。 hTIM蛋白的IgV包含高亲和性、磷脂组成的真核生物膜。
一般在细胞质膜的双层脂膜胞浆边发现,并在细胞凋亡的磷脂酰丝胺酸好发,同时移位到细胞质膜外叶,使细胞成为吞噬细胞中清道夫受体的目标。
TIM-3 有正负两种调节器可以用于免疫反应
TIM 蛋白也同时牵连了先天与后天性免疫反应中。 一般来说,TIM-3是在CD4+T细胞上表达干扰素伽傌(IFN-y) 、 CD8+T 细胞、调节 T细胞、以及先天免疫细胞 (DC、NK细胞、与单核细胞) 。 TIM-3同时还有另外一个目的,那就是做为Th1型免疫反应的调节器。 有许多证据指出TIM-3有正负两种调节器功能,可以用在免疫反应中不同元素里。
在癌症病患中, TIM-3 是被上调的肿瘤抗原 CD8+T 细胞与 CD8+TIL 。 TIM-3mAbs的管理让肿瘤抗原T细胞加强了增值能力与细胞因子繁殖。
癌细胞也能够表达 TIM -3 ,关系着疾病发展与降低生存时间
不过, TIM-3 表达不是仅限于单核细胞,它也被发现能够在不同的癌细胞中表达,例如骨随性白血病、肉瘤、、肠胃、颈椎、肺癌、与骨肉瘤。 在这些癌症疾病当中,TIM-3加强后的表达与疾病发展以及降低的生存率息息相关。
临床前研究显示抗 TIM-3 与检查点抑制剂联合治疗未来潜力
在临床前实验模型中, TIM-3 在老鼠肿瘤模型 TIL 有上调的趋势,其中包含了 CT-26 结肠腺癌模型、 4T1 乳腺癌模型、以及 B16-F10黑色素瘤模型。 光是TIM-3在管理上就只有尚可的抗癌效果,但是抗TIM-3与抗PD-1/PD-L1 结合的单克隆抗体却能够有效的抑制肿瘤成长。
一项临床前研究指出, TIM-3 mAb 注射能够减缓多种老鼠肿瘤模型中的肿瘤成长 (例如MC38结肠癌、WT3肉瘤、CT-26结肠腺癌、 以及TRAMP-C1前列腺癌)。 另外TIM-3 mAb与CTLA-4 mAbs或是TIM-3 mAbs 与PD-1 mAbs的结合,都有着更强大的抗癌效果。
这些研究皆证实能够阻挡免疫检查点抑制剂里的 TIM-3 。
临床发在还处于初期
目前只有两种 TIM-3 单株抗体都还在临床发展的初期 (例如MBG453与TSR-022) , MGB453(Novartis瑞士巴赛尔) 的安全性和效果已经在人类测试,在 Phase I-Ib/II 开放式多中心研究使用个别药剂与结合 PD-1mAbs 来治疗病患的恶性肿瘤。
TSR-022(TESARO美国沃尔瑟姆) 正被评估在人类实验第一阶段的个别药剂是否对实体肿瘤有效,之后便会开始研究做为个别治疗的安全性与临床活性,以及结合抗 PD-1 抗体的效果。
这些实验被期待有着绝佳的安全性与效果,希望 TIM-3 能够成为下一个强大的免疫检查点抑制剂。
延伸阅读与参考:
- Kobayashi et al. TIM-1 and TIM-4 glycoproteins bind phosphatidylserine and mediate uptake of apoptotic cells. Immunity. 2007;27(6):927-40.
- DeKruyff et al. T cell/transmembrane, Ig, and mucin-3 allelic variants differentially recognize phosphatidylserine and mediate phagocytosis of apoptotic cells. J Immunol. 2010;184(4):1918-30.
- Schlegel, Williamson . Phosphatidylserine, a death knell. Cell Death Differ. 2001;8(6):551-63.
- Ravichandran. Beginnings of a good apoptotic meal: the find-me and eat-me signaling pathways. Immunity. 2011;35(4):445-55.
- Fourcade, et al. Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specific CD8+ T cell dysfunction in melanoma patients. J Exp Med. 2010;207(10):2175-86.
- Gao et al. TIM-3 expression characterizes regulatory T cells in tumor tissues and is associated with lung cancer progression. PLOS One. 2012;7(2):e30676.
- Sakuishi et al. Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion and restore anti-tumor immunity. J Exp Med. 2010;207(10):2187-94.
- Nirschl et al. Molecular pathways: coexpression of immune checkpoint molecules: signaling pathways and implications for cancer immunotherapy. Clin Cancer Res 2013;19:4917e34.
- Ngiow et al. Prospects for TIM-3-targeted antitumour immunotherapy. Cancer Res 2011;71:6567e71.