对更多临床相关的临床前模型的需求,已被确定为有助于降低观察到的抗癌药物高损耗率的领域之一。更好的模型,如 HUB类器官的开发 – Crown Bioscience,可通过识别最有可能在临床试验中获得成功的药物来推动实现更佳药物发现决策。在本文中,我们将探讨新一代的“活体”肿瘤类器官生物样本库在识别具有改善临床相关性的抗癌药物方面所具有的价值。
什么是类肿瘤器官?
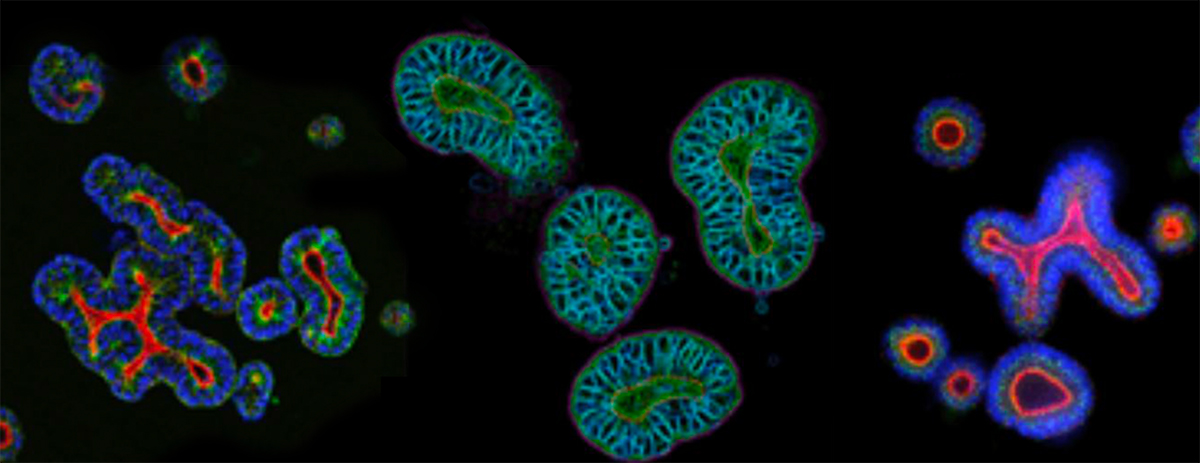
3D 体外类器官已成为许多研究应用的强大预测工具,不仅可以研究正常的发育过程,还可以研究癌症等疾病机制。简而言之,类器官是由成体干细胞生长而成的微观自组织 3D 结构。这些“微型器官”概括了原始来源的关键表型和遗传特性,使其与患者高度相关,并提高了临床相关性。
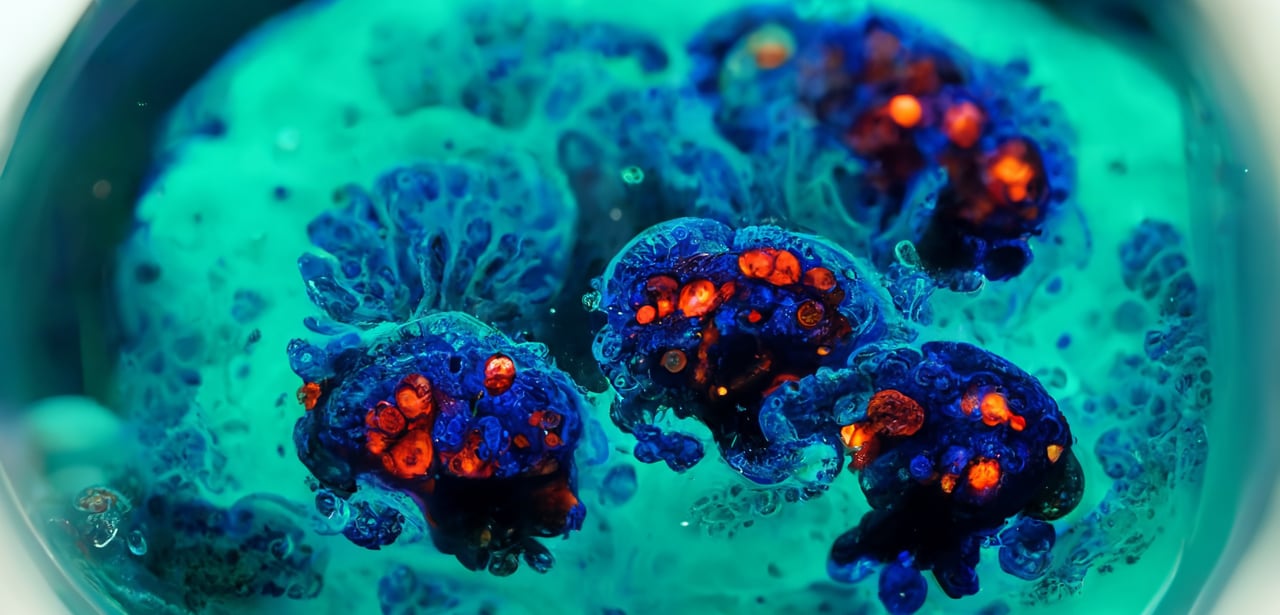
针对不同目的优化过的 HUB 专利方法,我们建立了开发了数百个疾病组织(包括肿瘤组织)和对应患者的正常组织模型。3D 体外肿瘤类器官模型可直接来自患者组织(即患者来源类器官[PDO]),或来自在小鼠 PDX 模型(如患者来源异种移植类器官 [PDX/PDXO]),这些模型代表了使用患者原代细胞的另一种选择。
与正常/健康肿瘤相似,肿瘤类器官高度概括了其来源的亲代肿瘤的特征,包括组织病理学、遗传/表观遗传特征,甚至药物敏感性。肿瘤类器官也具有可扩展性,即使在长期培养和冷冻保存后,它们在遗传和表型方面也具有稳定性。因此,与使用原代组织模型获得的数据相比,采用肿瘤类器官所获得的结果具有高度可重现性,并且由于类器官保留了原始肿瘤的许多关键特征,同时也可以利用进行相匹配的体内模型建立,从而可为早期体外研究到晚期基于动物的验证研究提供过渡。
总的来说,上述理想特征使肿瘤类器官对于识别具有改善临床相关性的抗癌药物方面别具价值。正如下一节所述,“活体”肿瘤类器官生物样本库意味着这些模型可用于支持大规模研究并保证重复研究具有可用性,尤其是在患者材料有限的情况下,同时捕捉到在患者人群中观察到的异质性,因为癌症不是一种单一疾病。
“活体”类器官生物样本库的优势
长期以来,肿瘤生物样本库一直被用于储存大量经高度注释的人癌症样本,这对研究人员来说是一种重要的资源。然而,这些样本的处理和储存方法往往限制了其在大规模体外筛选研究中的使用。
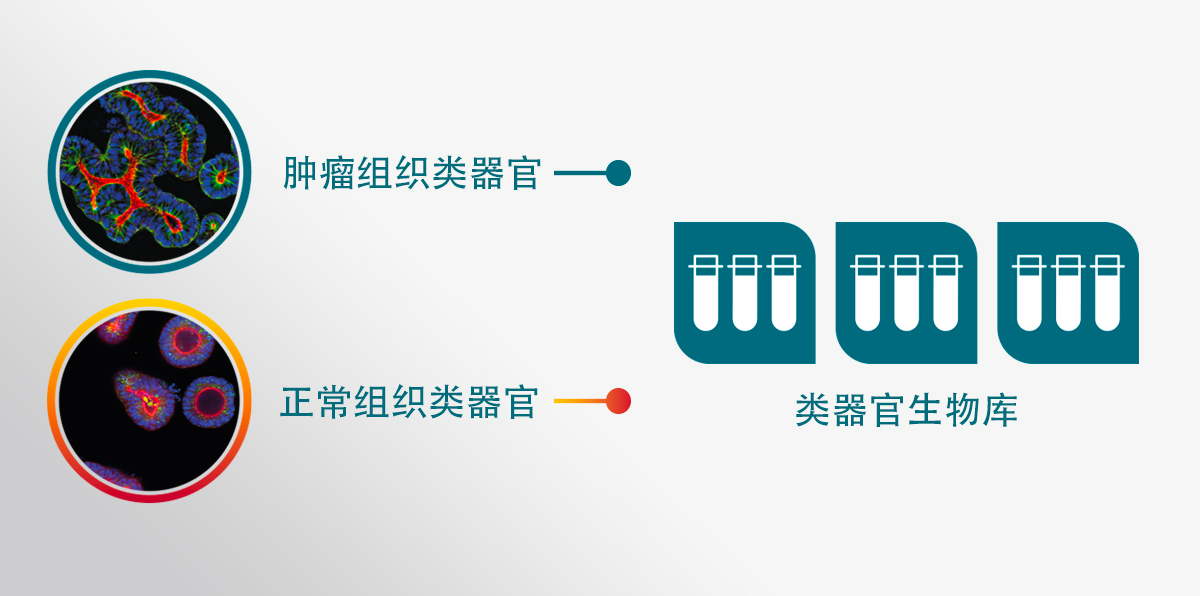
相比之下,通过冻存,已从 PDX 模型或直接从临床收集的原发患者样本中成功地使用健康组织(示例参见此处)和肿瘤组织生成了“活体”类器官生物样本库(分别形成 PDXO 和 PDO 生物样本库)。这种肿瘤类器官可用于生成活体生物样本库,因为可以根据需要对其进行冷冻保存、解冻和扩增(类似于细胞系),同时保留其匹配的患者肿瘤之关键遗传和表型特征。
目前已经建立了许多实体肿瘤类型的活体类器官生物样本库。冠科生物目前开发了 OrganoidBaseTM,这是一个可进行广泛搜索的生物样本库,由 342个肿瘤类器官模型组成,这些模型来自其 PDX 模型(即PDXO)库,其中包含与药物反应相关的组织病理学、IC50、基因组和转录组分析数据等相关信息,以及另外217个来自原发性患者样本(即 PDO)的模型。这些模型具有来自二十多种器官和组织类型之多个模型的不同适应症。
总体而言,每个类器官模型代表一个患者,它们共同代表着一个用于发现和筛选抗癌药物的强大平台,包括使用非自体免疫细胞共培养系统的免疫疗法。普遍认为,患者间和肿瘤内的变异性构成了临床环境中常见的缺乏反应和耐药性的基础。因此,健康和肿瘤类器官的大型生物样本库可用于模拟大规模研究中观察到的患者人群多样性,包括源自同一肿瘤内不同区域的肿瘤类器官。
此类生物样本库便于研究人员将临床试验引进实验室,有时称为“培养皿中的临床试验”,以识别具有反应的预测性生物标志物(基于基因组分析)、结合药物策略(例如,多剂量比、组合效应)并使用健康对照对治疗窗进行测试。高内涵成像(HCI)和高内涵分析(HCA)也被用于大规模的类器官筛选研究,以生成关于药物作用超出活力的丰富数据。
下图描绘了一个高度特征化的活体类器官生物样本库的开发,其中包含肿瘤类器官和组织相匹配的健康类器官,及其在癌症药物开发中的应用。

摘自:Zhou, Z. et al. Patient-Derived Organoids in Precision Medicine: Drug Screening, Organoid-on-a-Chip and Living Organoid Biobank. Front. Oncol., 30 December 2021. 可于以下网站获取:
https://www.frontiersin.org/articles/10.3389/fonc.2021.762184/full。基于知识共享署名4.0国际许可协议使用:
https://creativecommons.org/licenses/by/4.0/.
使用肿瘤类器官的挑战
虽然使用肿瘤类器官的获益显而易见,但研究人员仍应注意其中存在的一些挑战。例如,并非所有组织都适合类器官生成,并且存在着用于建立它们的不同方案,具体取决于来源组织和干细胞/祖细胞。不同方案的选择,可能是导致类器官质量和成功建立稳健培养物的可变性的主要因素,所有这些都会对数据的重现性产生负面影响。要了解类器官研究人员所遭遇的限制性问题,请查看最近的 STAR Protocols online Q&A forum STAR 方案在线问答论坛,标题为 “Organoids: questions and answers”。
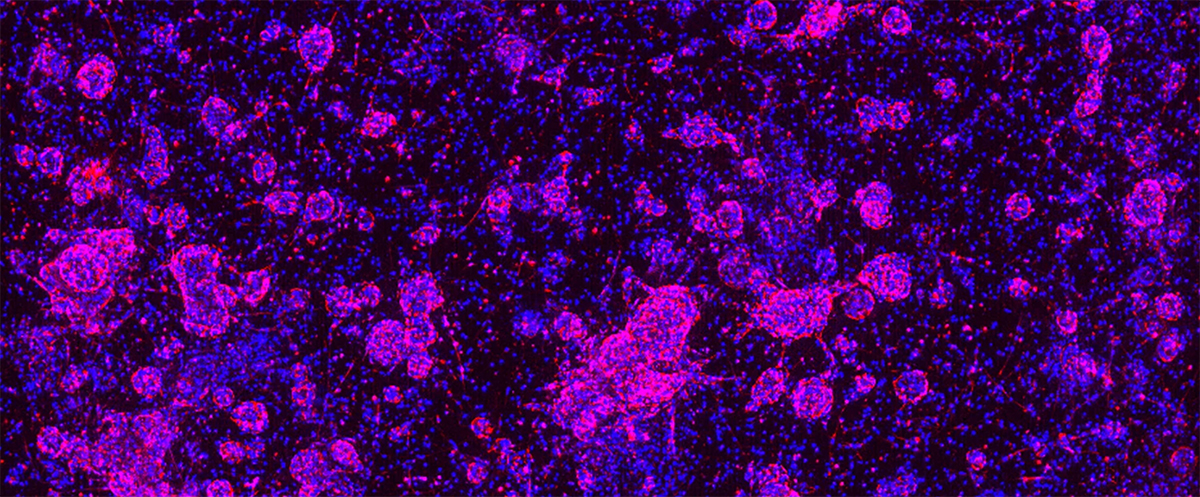
在类器官培养物中复制肿瘤微环境(TME)为另一项挑战,尽管现在已出现越来越多的肿瘤类器官共培养系统可以解决这个问题,并且这些系统已成功地模拟了免疫细胞迁移和免疫治疗效果。
结论
3D 体外肿瘤类器官准确地概括了原始患者肿瘤的基因组学、形态学和病理生理学特征。此外,它们比体内模型更容易进行扩展,即使经过长期培养和冷冻保存,它们在遗传和表型方面也具有稳定性。现已开发出活体肿瘤类器官生物样本库来支持大规模研究。这些类器官生物样本库可作为癌症药物开发的活体预测模型。目前,我们可以确保其具有可用性,同时也可捕捉患者人群的异质性(基因组学、组织病理学和免疫学多样性)。此类生物样本库被用于通过识别最有可能在临床试验中取得成功的药物,来推动实现更好的药物发现决策。
如欲详细了解冠科生物如何通过3D体外类器官帮助您推进肿瘤药物开发,请访问我们的网站:用于肿瘤药物开发的类器官.