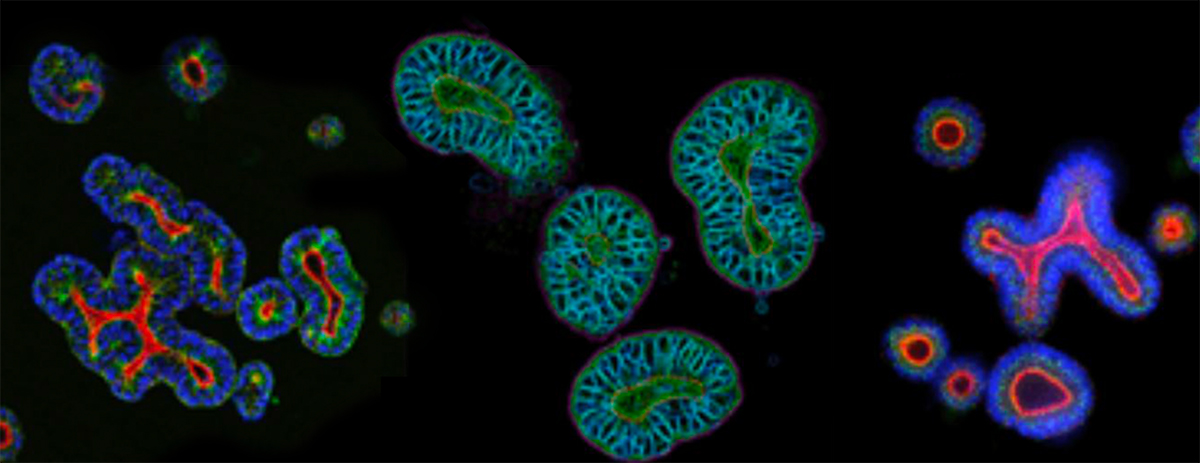
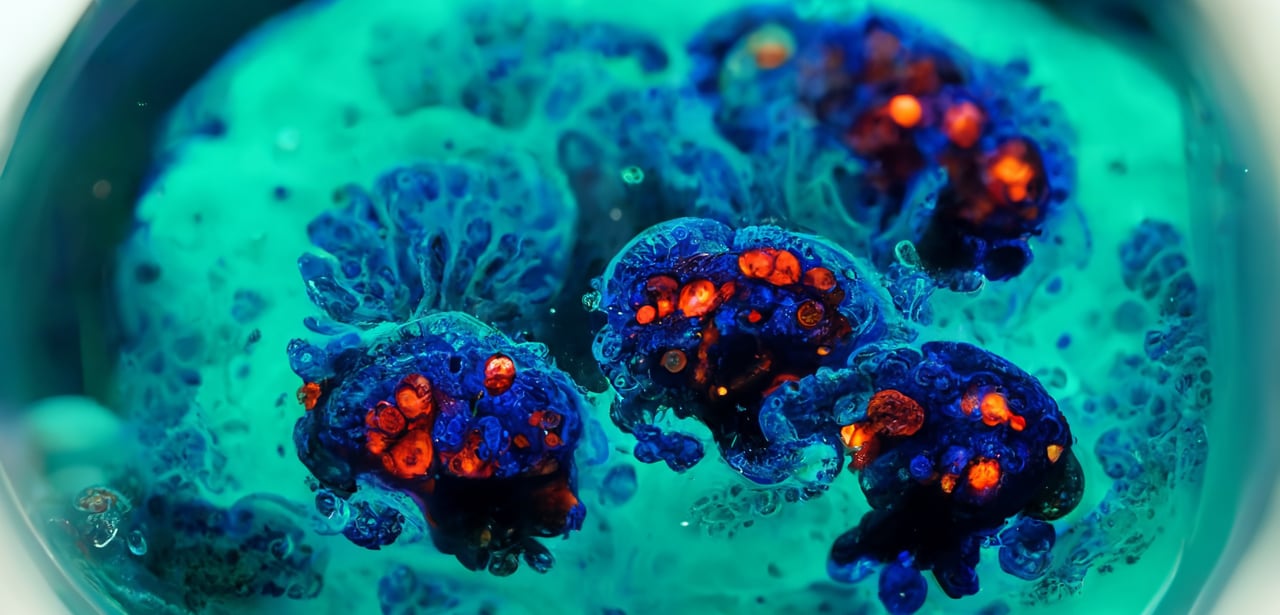
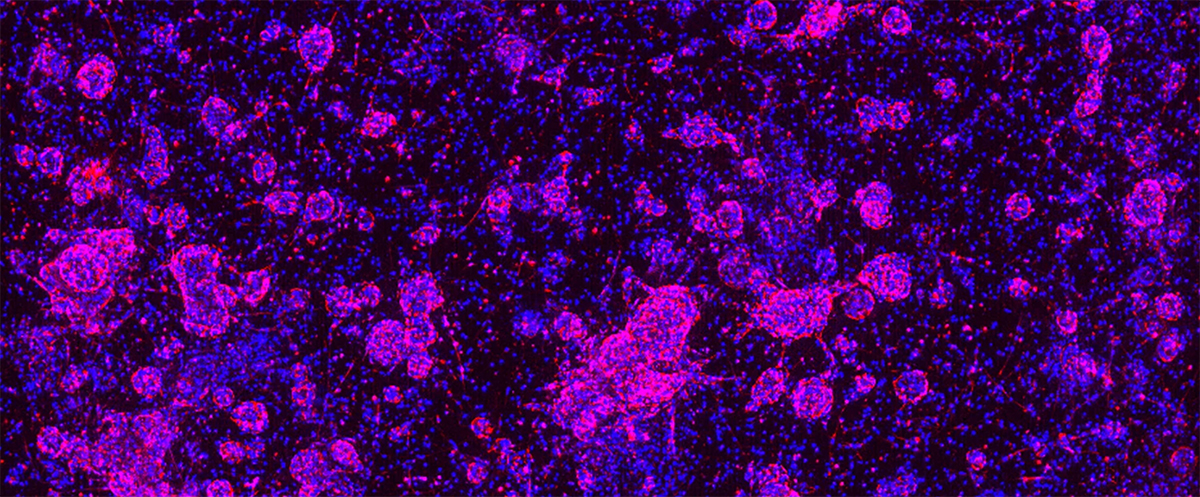
使用更具临床相关性的临床前模型,可通过更好地了解候选药物的安全性、疗效和机制,来降低抗癌药物损耗率,这一举措有助于对下游决策进行指导。
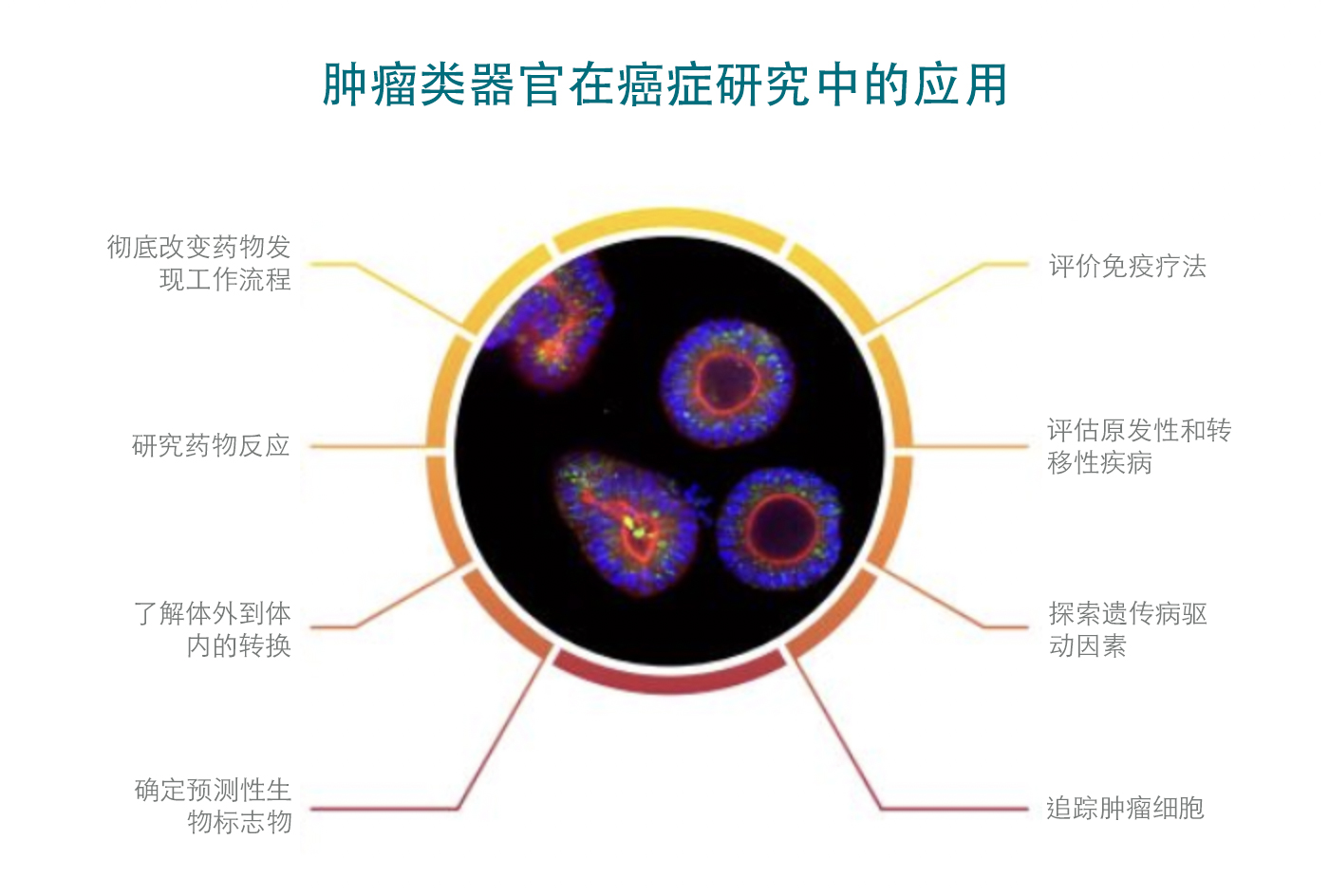
本文探讨了成体干细胞来源的 3D 体外肿瘤类器官在药物发现中的价值,特别是在鉴定具有改善转化潜力的抗癌药物方面,近期同行评议出版物中也强调了这一点。
什么是类器官?
“类器官”一词曾被用于代指在不存在附着底物的情况下细胞生长时产生3D结构的细胞组。
如今,类器官特指具有细胞的3D结构,这些细胞建立或保留了被建模器官/组织的身份,包括干细胞及其子代。类器官通常来源于多能干细胞(PSC),即胚胎干细胞或诱导的 PSC,或多能器官特异性成体干细胞(ASC)。
类器官由发现于特定亲代器官/组织中的多种细胞类型组成(可为健康或患病的器官/组织,如肿瘤组织),表现出其功能特性的某些方面,并遵循与原始器官/组织相同的内在原则进行自组织。
类器官与其他 3D 模型有所不同。例如,球状体由单个细胞类型或细胞混合物形成 ,可来源于干细胞、原代细胞、永生化细胞系或人体组织。它们也由多层细胞组成,可导致细胞出现异质性,包括细胞充氧、缺氧、增殖、非增殖和/或坏死。
PSC 来源类器官和 ASC 来源类器官之间的关键差异
PSC 类器官通常用于模拟器官形成。然而,与开发基于 ASC 的类器官相比,生成 PSC 类器官的方案更为耗时和复杂(更深入的讨论参阅我们之前的博文)。
简而言之,ASC 来源类器官规避了生成 PSC 类器官所需的一些步骤,因为它们是使用优化方案由组织特异性干细胞群建立。
较为稳妥的方案使用优化条件来保留干细胞自我更新和分化纯化的单个 ASC 或组织特异性微观结构的潜力。由此产生的类器官准确地概括了其原始组织的表型和遗传特征。
已发表研究数据表明(例如,参见此处、此处和此处),类器官是首个临床相关的3D体外模型,其显示出以下特征:
- 长期培养和冷冻保存后的基因组和表型稳定性;
- 相对于体内模型的易扩展性;以及
- 临床可预测性。
此外,在冷冻保存后,类器官的基因组和表型稳定性使得活体类器官生物样本库 (如OrganoidBase™)的开发具有可能性,该样本库中包含涉及多种实体癌类型的模型,并在体内临床试验中使用类器官替代受试者。该方法相当于临床试验,只是它是在培养皿中进行的,因此可以加快药物研发速度并降低肿瘤候选药物的高失败率。
ASC 来源类器官的价值:可扩展性、重现性和临床相关性
成体干细胞来源的体外肿瘤类器官是癌症药物发现和开发的强大预测性临床前模型,而这一功能很大程度上归功于其具有可扩展性、可靠性和较高的患者预测性。下述为近期两项研究的总结,这两项研究强调了肿瘤类器官在癌症药物发现和开发方面所具有的优势和潜力。
在发表于 PLOS ONE 上的一项研究中,冠科生物的科学家们报告了从 PDX 库中开发出患者来源的异种移植类器官(PDXO)的生物样本库。该研究旨在评估 PDX 和相应 PDXO 之间的生物学等效性或可互换性,并对其药理学反应进行比较。
科学家们对超过 550个所匹配的代表多种癌症类型的体外和体内模型开展了测试。总体而言,经大量的基因组和组织病理学表征证实了两种类型模型之间的生物学等效性。体外 PDXO 和体内 PDX 药理学之间存在高度相关性。
生物样本库还成功用于先导化合物和适应症的高通量“基质”筛选、免疫疗法的免疫细胞共培养和体外/体内成像的基因工程。总而言之,所得出的结论为
“这个涉及不同癌症的涵盖 > 550对匹配PDX/PDXO的大型生物样本库可能成为未来癌症药物发现的有力工具。”
Nature Cancer上的第二项研究报告了一种双特异性抗体的临床前数据,该抗体在实验模型中被证明可预防转移的发生,并可减缓原发性肿瘤的生长。
在异质性结肠直肠癌 PDO 生物样本库(采用优化方案开发)和配对的健康结肠黏膜样本上进行了双靶向双特异性抗体(bAb)的大规模功能筛选。
简而言之,通过高内涵成像对针对无翅基因相关整合位点(WNT)和受体酪氨酸激酶靶标产生的 500 + bAb 进行了功能性评价,以捕获 PDO 反应的复杂性。这使得我们能够识别出对大量突变特征和肿瘤亚型具有活性的抗体,并通过命中验证和作用机制研究,来选择出性能最佳的抗体。
这一策略推动了 MCLA-158 的鉴定工作,MCLA-158 为一种 bAb,在富含亮氨酸重复序列的G蛋白偶联受体5阳性(LGR5+)肿瘤干细胞中触发表皮生长因子受体降解,但对健康的 LGR5+ 结肠干细胞的毒性极小。
在几种上皮癌类型的匹配PDX模型中证实了 MCLA-158 的治疗特性(即,KRAS 突变结直肠癌的生长抑制作用、转移起始阻断作用和肿瘤生长抑制作用)。
这项突破性的工作通过将发现之初至开展临床试验之间的时间缩短至大约五年,从而证实了3D体外肿瘤类器官所具有的优势。
结论
类器官在癌症药物发现和开发中日益普及,因为与体内和其他体外模型相比,它们在可扩展性和临床预测性之间达到了平衡。此类模型准确地反映了原发性肿瘤的基因组学、形态学和病理生理学特征。总体而言,类器官在提高癌症药物发现的效率和取得癌症药物发现的成功方面具有巨大的潜力,并且是未来研究中一种极具前景的研究途径。
请访问冠科生物的用于肿瘤药物开发的类器官网站,详细了解我们如何帮助研究人员推动其药物发现和开发项目。