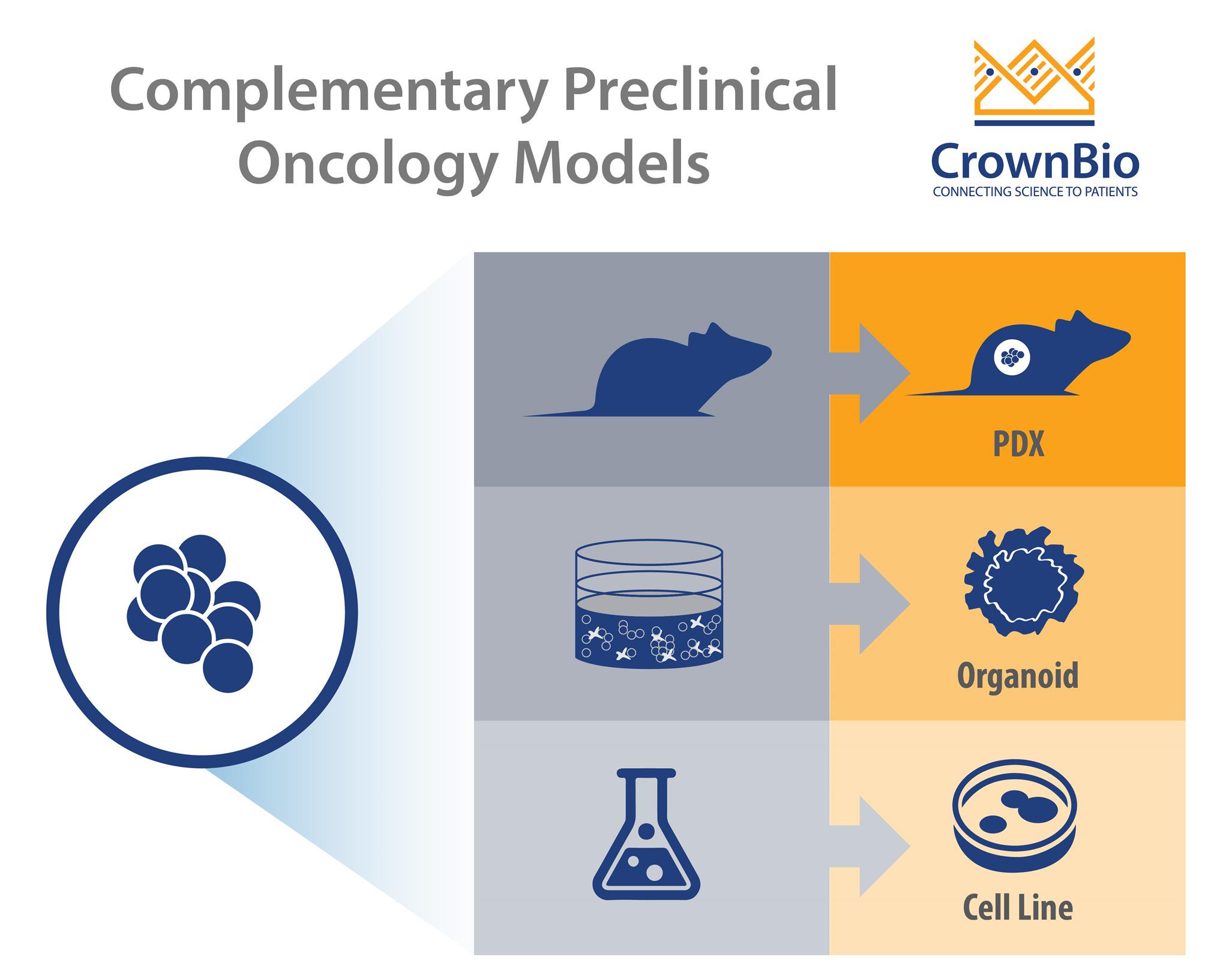
许多新临床前癌症模型正在研发中,各模型都有其自身优势及最佳使用。本文着眼于3D癌症类器官,其如何填补简单2D体外实验与体内细胞株及患者源性异种移植(PDX)模型之间的空白。
利用传统临床前资源整合3D肿瘤模型
2D体外试验无法准确预测体内反应,是导致癌症治疗学高损耗率的因素之一。因此,根据与人类生物学和疾病基因型、表型的相似性,选择适用临床前模型,传统上依赖于动物模型。
最近,我们讨论过3D体外模型(如肿瘤球体和器官模型)可提供的新机会。这包括构建和应用功能3D体外人体肿瘤转化模型,以供肿瘤研究、免疫治疗研究和药物筛选。
伴随肿瘤细胞株的多样性和临床前模型的可用性,现在需要知道何时用合适的模型来发挥合适的研究作用。这包括把诸如3D癌症类器官之类的新模型整合至现有临床前策略中,以填补2D体外和常规体内试验之间的空白。
用于初始药物筛选的癌细胞株
2D体外筛选是早期临床前研究的基础。癌细胞株通常价格低廉,易于生长,易于接受大细胞株试验对象中大量小分子化合物库高通量药物筛选。
这能提供细胞死亡率的相关信息,同时还能识别药物靶向和潜在生物标志预测反应。我们对大量癌细胞株分子谱进行深入了解,有助于在药物研发中定向施药。
然而,众所周知,细胞株适于在塑料件上生长,与原发病出现偏移,丧失真实疾病的代表性和潜在的预测能力。2D培养也无法在原位捕捉3D肿瘤生物学的真实性。
早期体内药理学的细胞株源性异种移植
把癌细胞株植入免疫缺陷小鼠模型中,生成传统细胞株源性异种移植,重建的环境更趋向于生理。这些模型为体内药物研发提供了一个良好工具。
体外经过筛选至药物研发新维度——体内药理学,传统异种移植携带在此期间得到的信息。此时,在宿主决定因素(如ADME和药物动力学)的背景下,体外发现的活性也可在体内评估。
异种移植可快速运行,生成结果与大量的历史数据进行对比,这样就提出一个快速概念验证,为新试剂在特定指标中或针对特定过表达蛋白发挥作用。传统异种移植的典型用途包括:
- 多个潜在候选项或复合级数的初始评估。
- 针对已知细胞株靶向,对新制剂疗效进行评估并排序。
- 了解新药特性或MOA。
全面
传统异种移植重现细胞培养问题
传统异种移植是通过培养细胞株生成,即细胞株受到2D细胞培养的诸多限制。在异种移植中,包括克隆选择结合细胞应激影响基因表达和蛋白功能的问题。
虽然有文献报道称,异种移植细胞株肿瘤及其相应主要肿瘤具有相同的组织学特征,但另有文献发现这些异种移植细胞株肿瘤无法再现原发性肿瘤组织学特征。此外,根据药物靶向和/或适应症,传统异种移植模型上的活性治疗药物与人类患者活性的相关性较差。
例如,在研究中利用胰腺导管腺癌(PDAC)异种移植,发现相关性较低,这可能是由于在人类胰腺导管腺癌(PDAC)中发现密集促纤维增生基质及低血管密度,在恶性肿瘤异种移植中无法重现。
此时,胰腺导管腺癌(PDAC)基因工程小鼠模型(GEMM)提供了一种可选模型。胰腺导管腺癌(PDAC)基因工程小鼠模型(GEMM)表现出与人类胰腺导管腺癌(PDAC)极为相似的特征,以致密基质为表征,导致高间质压力和血管塌陷。
在体内试验中患者源性异种移植(PDX)更有预测性
患者源性异种移植(PDX)模型,把患者肿瘤组织直接植入免疫缺陷小鼠体内,从而消除体外选择压力的问题。然后把患者源性异种移植(PDX)通过连续传代的方式进入更多动物体内(P1、Pn等)。这些模型不断在体内维持,带有细胞类型多样性及肿瘤微环境,与人类肿瘤微环境极为相似。
在这方面,患者源性异种移植(PDX)在建立时,几乎完全重现了患者肿瘤基因型和表型。此外,患者源性异种移植(PDX)在连续传代后,瘤内克隆结构基本守恒。
在准备临床试验做药物研发项目时,患者源性异种移植(PDX)最为理想化,因为这些项目具有高可译性——在这种情况下,护理标准反应与患者临床反应相关密切,这为指导适应证或患者临床分层和理解耐药机制提供了高预测性数据。
患者源性异种移植(PDX)模型无及时适应高通量分析
然而,由于在小鼠体内建立患者源性异种移植(PDX)肿瘤需要时间和成本,患者源性异种移植(PDX)平台的使用与大规模、快速筛选缺乏兼容性。为克服这一问题并建立综合药物研发项目,方法是将患者源性异种移植(PDX)转至体外和体内早期阶段。
在这方面定位,已从患者源性异种移植(PDX)中获得细胞株,基本保持了组织病理学特征和原患者肿瘤遗传特征。即在患者源性异种移植(PDX)中瞄准的任何罕见融合或突变,细胞筛选时依然会出现。这也包括生化信号及肿瘤细胞自主靶向治疗反应等特征。
患者源性异种移植(PDX)源性细胞株也可建为“传统”异种移植模型,在一个可靠系统中再次为早期药物研发提供遗传特征。患者源性异种移植(PDX) 源性细胞株也可进行3D培养,这就更近似于原位肿瘤生物学。然而,建立这些细胞株也很费时,且并非保证每个案例都能成功。
高通量、3D大规模药物筛选的类器官
正如之前文章中的详细描述,从新活检中获得类器官原发性组织的3D模型。类器官含干细胞,其具有自我更新和分化特性,可生成含几乎任何细胞类型的3D结构。
这些细胞表现出与相应器官相似的空间组织,能够再现该器官的某些功能,提供一个与生理学高度相关的系统。此外,类器官保留细胞-细胞和细胞-基质的相互作用,更类似于原始肿瘤。正常组织的类器官也可用于描述任何偏离靶向毒性。
与传统异种移植模型相比,类器官比患者肿瘤更具有结构和生理的相似性。这包括超过类器官培养液延长期的稳定基因组谱,即使在培养液延长期过后,耐药性组谱 还能稳定。
与患者源性异种移植(PDX)模型相比,建立类器官更快更准,从繁殖到药物疗效结果之间仅有2-3个月的时间间隔。这些模型可进行基因改造,与大规模药物筛选兼容。类器官模型和患者源性异种移植(PDX)模型的药物反应模式相似。
从肿瘤类器官中也可成功建立患者源性异种移植(PDX)模型,匹配类器官和患者源性异种移植(PDX)表明,与源性亲代肿瘤有相似的组织病理学特征。
在免疫缺陷小鼠中建立并繁殖患者源性异种移植(PDX)模型,同时类器官也可用免疫系统成分研究,与患者自体免疫细胞共同培养,然后评价免疫疗法。
结论
综上所述,原发组织类器官填补了2D细胞培养液/异种移植模型与患者源性异种移植(PDX)模型临床前模型库中的空白。随着研究的深入,类器官可能会成为标准临床前药物研发过程的一部分。