了解导致HUB类器官开发的关键研究发现。
HUB类器官开发中的关键发现
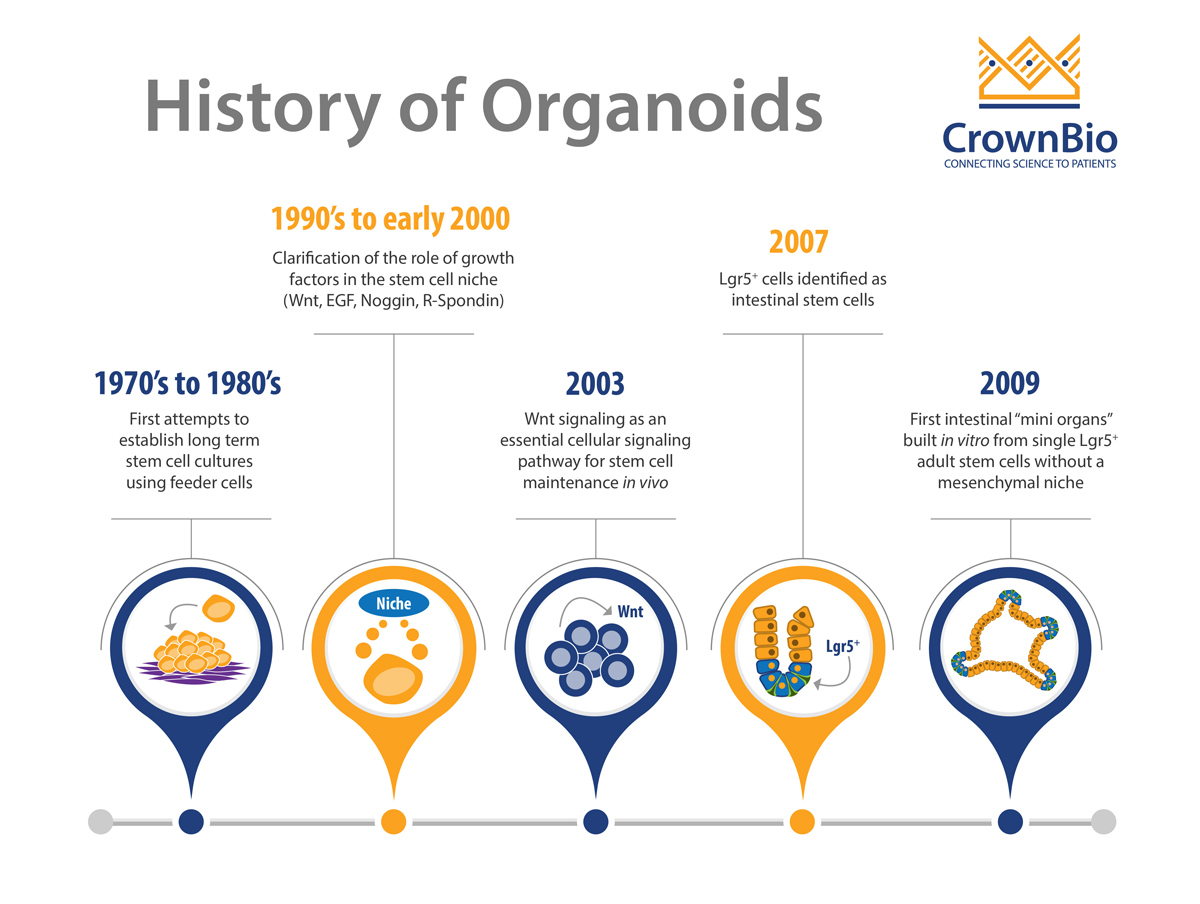
如今,成体干细胞来源的HUB类器官是数十年大规模研究的成果,涵盖了干细胞培养的一系列历史性研究关键发现。
早期关键发现:干细胞培养物用于发育生物学研究
最初的离体干细胞扩增研究重点是建立长期干细胞培养物以模拟人体发育。这些努力可以追溯到20世纪70年代末和80年代初,当时成人角质细胞或胚胎多能细胞与成纤维饲养细胞层进行了共培养。这些为不确定的干细胞巢因子提供了细胞来源,尽管当时仍是未知。
尽管做出了这些努力,在饲养细胞存在的情况下生长的干细胞很快表现出遗传学不稳定性,并丧失了全部分化潜能。这意味着体外分化可能会受到一定程度的限制并且不可预测。作为预防步骤,将培养的(推定的)干细胞移植到小鼠中,查看它们是否仍然具有定义以下特征的干细胞:1)自我更新能力和2)分化成多个谱系。
随后的关键发现:增强对干细胞巢的了解以及干细胞自我更新和分化的调控
随后的两项发现导致优化了从人体多潜能性器官特异性成体干细胞(ASC)(现在称为“ HUB类器官”)建立类器官的方案。
Clevers实验室发布的第一个里程碑是发现Lgr5作为鉴别肠道成体干细胞的生物标志物。这一发现首次使ASC的表征、纯化和体外扩增成为可能。
这些ASC增殖并可以长期培养维持的观察结果导致使用分离的Lgr5+干细胞作为类器官培养的推定细胞来源。这项开创性工作导致开发出首个肠道“微型器官”(特别是隐窝-绒毛类器官)。
第二个主要发现是加深对干细胞巢以及调节干细胞自我更新和分化的因素的理解。这个关键方面意味着不再需要饲养细胞。反而,干细胞培养环境仅补充了器官特定的生长因子混合物。
Clevers研究小组证明,在没有间充质细胞巢的情况下,可以由单个干细胞产生自组织的近天然肠上皮结构,从而打破了传统观念。
HUB类器官培养
HUB类器官培养基于Clevers实验室和HUB优化的改进方案。这包括多年来对类器官培养基的优化。改良培养基可以在没有间充质细胞巢的情况下从上皮ASC生成类器官培养物,包括
- 干细胞巢因子:上皮生长因子(EGF)、Noggin和R-spondins,研究发现显示
- Wnt信号传导是体内干细胞维持的基本细胞信号通路。
- EGF是有效的有丝分裂原。
- R-spondins,后来经鉴别为与LGR5结合的Wnt激动剂,是导致干细胞增生的有丝分裂原。
- 骨形态生成蛋白(BMP)抑制剂“ Noggin”对于维持干细胞巢至关重要。
- Wnt信号传导是体内干细胞维持的基本细胞信号通路。
- 一种rho激酶(ROCK)抑制剂,研究工作显示,将其添加到原代培养物中成功抑制了先前在纯化的结肠上皮细胞中观察到的失巢凋亡(一种发生在贴壁依赖性细胞中的细胞死亡形式)。
- 最后,在Matrigel中包埋纯化的ASC提供了细胞外基质(ECM)的关键离体替代物。在饲养层培养物的之前经验显示饲养细胞(即成纤维细胞)产生ECM来支持干细胞生长后才选择此方法。组织培养塑料器具与ECM蛋白(例如胶原蛋白或层粘连蛋白)的预孵育进一步增强了干细胞的克隆形成能力。同样,基于ECM的水凝胶(例如Matrigel®)可以促进3D聚集和(干)细胞极化。
使用这些方法,HUB类器官现在来源于上皮组织范围。
HUB类器官发现——接下来是什么?
近期的发现使类器官培养物可用于评估免疫疗法。
尽管HUB类器官确实忠实地体现了人类上皮器官的形态发生和发病机理,但它们缺乏复杂体内有机体中发现的器官之间的联系。具体而言,对于癌症等疾病,肿瘤本身与免疫系统之间的合作对于疾病建立和进展至关重要。因此,需要癌细胞和免疫细胞来有效地评估免疫疗法。
新研究显示,肿瘤类器官可以与自体激活的T细胞共培养。自体肿瘤类器官和外周血淋巴细胞的共培养被用于从错配修复缺陷型结直肠癌和非小细胞肺癌患者的外周血中富集肿瘤反应性T细胞。然后将这些T细胞用于评估杀死匹配的肿瘤类器官的效率。
结论
类器官培养物是多项历史研究发现的结果,包括早期研究显示干细胞可以在体外培养,随后的研究则进一步改善了我们对干细胞巢以及干细胞自我更新和分化调控的理解。
如今,HUB类器官优化方案已广泛用于生成可以在体外长期维持的稳健且可重现的类器官培养物。