癌症中FGFR家族复杂畸变范围、及PDX模型(人源化肿瘤异种移植体内模型)如何成为评估新FGFR靶向疗法的有力工具
癌症发展涉及的多重通路
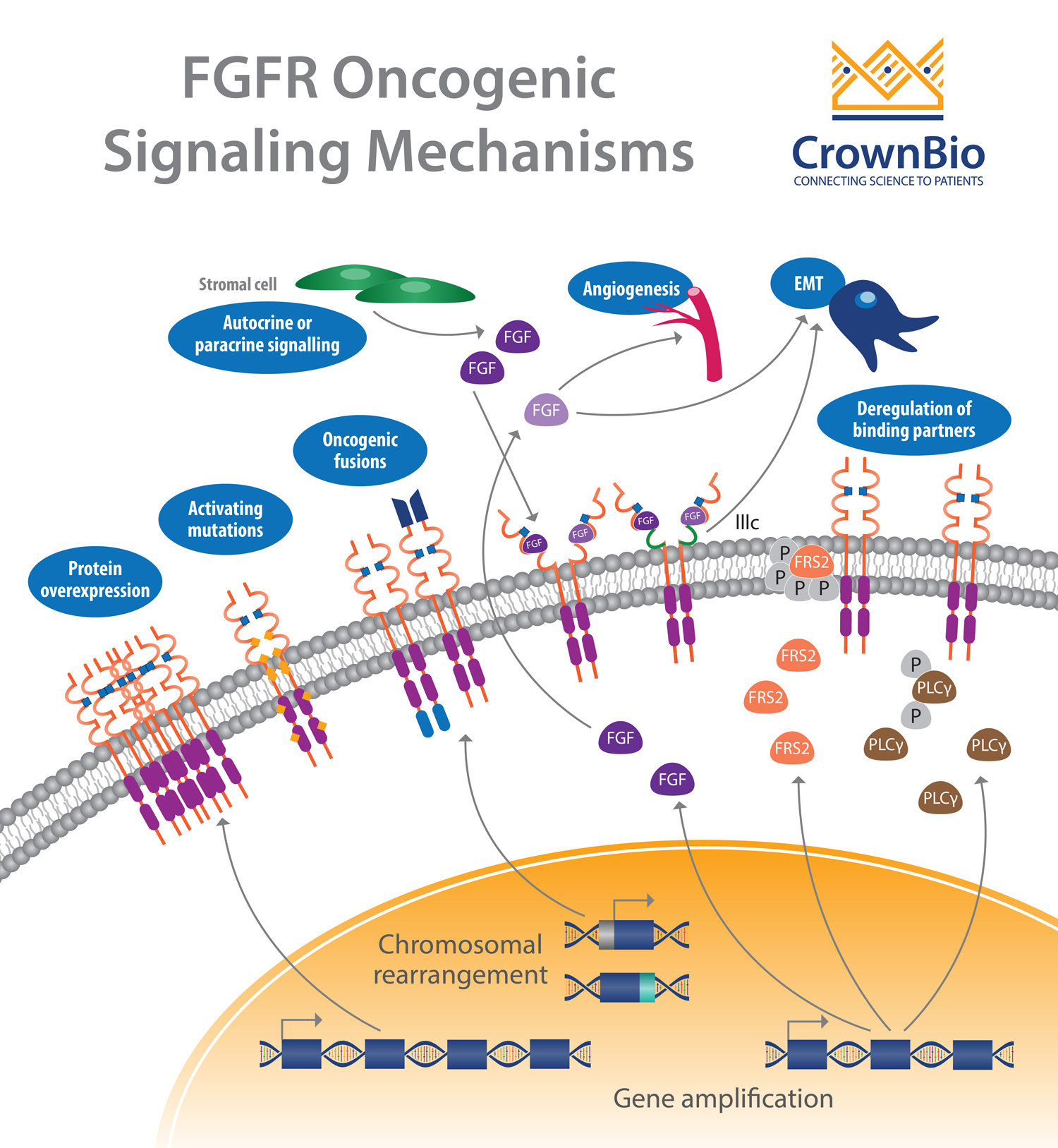
异常受体酪氨酸激酶的信号传导往往导致涉及肿瘤发生的许多通路下游过度活化。其中之一是RAS通路;我们之前已经讨论了为什么RAS家族基因突变在癌症发展中起重要作用,以及在治疗中如何靶向这种突变。另一种受影响的通路以成纤维细胞生长因子受体(FGFR)为中心,其在人类癌症中经常被改变。成纤维细胞生长因子(FGF)/FGFR信号传导下调涉及多种类型的肿瘤发生、发展、和对治疗的抗性。
FGFR家族
FGFR家族中共有4个FGFR家族成员,FGFR1至FGFR4,它们在调节细胞生长、增殖、分化、伤口愈合和血管形成中扮演着重要角色。
FGF介导的FGFR活化导致特定酪氨酸残基的磷酸化,这启动了一系列细胞内事件,激活了主要的细胞生存和增殖信号通路,例如RAS-MAPK,PI3K-AKT,PLCγ和STAT。
癌症中的FGFR异常
最近的研究通过新一代测序(NSG)分析了超过4,850个肿瘤,对不同癌症类型中发现的FGFR畸变范围进行了广泛的综述。
总体而言,7%的受试肿瘤具有FGFR畸变,不同FGFR家族分配比例为:
- FGFR1 – 49%
- FGFR2 – 19%
- FGFR3 – 23%
- FGFR4 – 7%
基因扩增(66%)导致了大部分的FGFR畸变,其次是突变(26%)和重排(8%)。几乎每种癌症都存在一些具有FGFR畸变的肿瘤。在尿路上皮癌(32%)、乳腺癌(18%)、子宫内膜癌(∼13%)、鳞状肺癌(∼13%)和卵巢癌(∼9%)中则观察到更高的频率。
FGFR扩增
在约15%的鳞状非小细胞肺癌(NSCLC)和10%的乳腺癌(主要在激素受体阳性疾病中)中发现FGFR1扩增(8p12位点)。在卵巢癌、膀胱癌、肾细胞癌和横纹肌肉瘤中也观察到FGFR1扩增,但比例较小。
另外,较FGFR1扩增,FGFR2扩增更少见,目前FGFR2扩增在约8%的胃癌和2%的乳腺癌中被观察到。FGFR3和FGFR4的扩增不常被报道,这些受体的激活通常与体细胞突变有关。
FGFR突变
研究发现,体细胞活化FGFR点突变导致多种异常信号传导机制。而与其他酪氨酸激酶受体(如EGFR)相反,大多数FGFR点突变常在激酶结构域外被观察到。在这类突变中,与罕见的FGFR1突变相比,FGFR2和FGFR3的突变更频繁。
FGFR2突变主要由错义激活突变(S252W、P253R)组成,在约12%的子宫内膜癌中有发现,而在NSCLC、胃癌和尿路上皮癌中的比例较低。
FGFR3突变发生在跨膜(G370C、Y373C)或细胞外(R248C、S249C)结构域中,其能导致活化增强和受体二聚化增加。
FGFR3突变在大约75%的侵袭性尿路上皮细胞癌、15%的高级侵袭性尿路上皮癌和约5%的宫颈癌中被发现。
最后,FGFR4突变(K535,E550)存在于激酶结构域中,在7%的横纹肌肉瘤中发现其存在并诱导受体自身磷酸化。
除了体细胞激活突变外,研究发现FGFR系单核苷酸多态性(SNP)与癌症风险的增加或不良预后有关。
FGFR基因融合
基因融合是易位、间质缺失或染色体倒位的结果。FGFR基因融合发生率很低,其中涉及FGFR2和FGFR3的融合最常见。
在恶性脑肿瘤(即成胶质细胞瘤)中首次观察到重复出现的FGFR融合体(FGFR3-TACC3),之后在膀胱、肺癌中也有发现。
FGFR1融合虽然非重复(即ZNF198、BCR、FOP),主要见于骨髓增生性疾病干细胞白血病/淋巴瘤综合征(SCLL / 8p11骨髓增生综合征),但在肺鳞状细胞癌(LUSC)、乳腺癌、胶质母细胞瘤和良性脑肿瘤中也有发现。
FGFR2融合(即CIT、CCDC6、CCAR2、OFD1、BICC1等)在15%的肝内胆管癌中发现,鲜见于甲状腺、肺和前列腺癌。
下调自分泌/旁分泌循环
除了导致配体非依赖性信号传导和组成型受体激活的遗传异常之外,涉及FGF和FGFR的配体依赖性信号传导也可以被下调。
下调FGF在癌症细胞或间质细胞中表达和分泌有助于或驱动癌症发生。临床前研究中,在一项使用小鼠乳腺肿瘤病毒(MMTV)改造获得的基因工程模型(GEM)研究中,诱导的乳腺肿瘤中发现了增加的FGF8、FGF4和FGF3表达。
最近,多重FGF已经在多种癌症中被发现,包括乳腺癌、前列腺癌、结肠直肠癌、肝细胞癌和NSCLC。
治疗性地靶向FGFR家族
鉴于FGF / FGFR通路的许多改变,多种治疗策略已被开发或正在研究中,包括非选择性、选择性FGFR酪氨酸激酶抑制剂(TKI)、拮抗剂抗体、或FGF配体捕获。
非选择性FGFR TKI(如,多韦替尼、lenvatinib、lucitanib、nintedanib)与受体催化位点的ATP结合结构域结合,但也可以靶向其他RTK(如VEGFR和PDGFR)。
选择性的FGFR抑制剂被具有增加其特异性、并降低多靶向TKI相关的毒性的优点,包括如AZD4547、NVP-BGJ398、JNJ-42756493、LY2874455、TAS120和Debio-1347的化合物。
而几种靶向FGF / FGFR的单克隆抗体尚处于处于临床前或研究早期阶段。这些抗体通过干扰配体结合或受体二聚化来阻断FGFR信号传导,这些抗体包括抗FGFR3(MGFR1877S)、抗FGFR2-IIIb(GP369,FPA144)和抗FGFR2(BAY1187982)。
除此之外,防止FGF配体与FGFR结合也是一种治疗策略。可溶性融合蛋白FP-1039(GSK3052230)由与IgG1的Fc区融合的FGFR1c的细胞外结构域组成,阻止FGF1、FGF2和FGF4结合;FP-1039在肺癌患者化疗中评估(NCT01868022)已经完成了IB期临床试验。
用PDX模型临床评估FGFR靶向治疗
虽然多种FGFR靶向治疗策略在开发中,但迄今为止临床反应有限。为了更好地评估不同的FGFR靶向治疗策略,需要改进的临床前模型,比如其具有不同FGFR临床畸变的复杂相互作用和机制的、更具预测性的模型。
人源化肿瘤异种移植体内模型(PDX)是与临床高度相关的、重现人类疾病的临床前模型。提供的模型具有临床相关的FGFR畸变(如FGFR3融合,包括FGFR3-TACC3)。整理PDX NGS数据库还允许搜索和选择具有罕见FGFR融合或突变的模型,这些在传统CDX模型中都是难以发现的。
许多研究已证明PDX适用于多种癌症的FGFR靶向疗法研究,例如胆管癌、子宫内膜癌、SCLC、胃癌和HCC癌。
小鼠临床试验
用于Mouse Clinical Trials的大规模PDX模型可以模拟患者II期试验。每个PDX受试动物反映其原始患者的病理学,代表患者,并且受试动物群组可反应人类患者群体的多样性。这些特点就允许研究者能在FGFR突变/融合疾病的群体范围中测试药物,并评估不同的畸变如何影响其对药物的反应。
除了测试受试群对药物的反应外,PDX小鼠临床试验的另一个主要用途是鉴定预测性生物标志物。最近一项肺鳞状细胞癌(LSCC)中的多韦替尼研究已经实现了这一点,该研究表明与FGFR途径激活相关的基因组过表达可能是LSCC患者中FGFR抑制剂的潜在生物标志物。
总结
FGF / FGFR信号传导途径是复杂的,在多种癌症类型中具有多种改变和异质性行为。 目前,多种FGFR抑制剂正在开发中,但迄今为止这些在研药物的临床反应仍十分有限。
临床前测试需要更类似PDX的临床相关模型和预测性临床前模型。这些模型将有助于我们更深入地了解药物作用机制,并改进对新药物和联合疗法的评估,以克服目前有限的疗效。另外,新模型还可以有助于进一步识别预测性生物标志物。