探索类器官和球状体(建立3D细胞培养系统的最常用方法)之间的异同。
建立3D培养的体外方法
2D单层细胞培养一直是药物研发的主要手段,但对于某些应用而言,它们并非理想选择。例如,它们在细胞微环境发挥至关重要作用的疾病(如癌症)建模中的作用较小。因此,科学家们多年来一直致力于开发3D培养系统, 以更好地体现体内细胞反应,包括预测药物反应。
现在有建立3D细胞培养的多种选择。为每项研究选择正确的方法取决于细胞的性质和来源、实验目的以及研究课题。
基于支架与无支架的培养
通常,3D细胞培养系统可大致分为基于支架的系统或无支架系统,两种系统各有优缺点:
- 基于支架的系统使用天然或合成材料作为种子细胞聚集、增殖和迁移的支撑,最终生成3D结构。
- 无支架系统依赖于通过专门的培养皿或阻止细胞附着的物理参数来促进细胞的自聚集。
对于3D培养,无支架系统可能是首选,因为它们没有外源性结构来阻止药物或生长因子传递。但是,在无支架系统上形成的3D结构的尺寸往往不规则,并且在没有支架的情况下某些细胞类型根本不会聚集。
基于支架的系统可以更好地控制形成微结构的设计和架构。所使用的支持基质也可以进行功能化以更好地在体内复制细胞环境。务必注意,支架本身可以吸附测试化合物,这需要作为因素纳入药理学研究中。
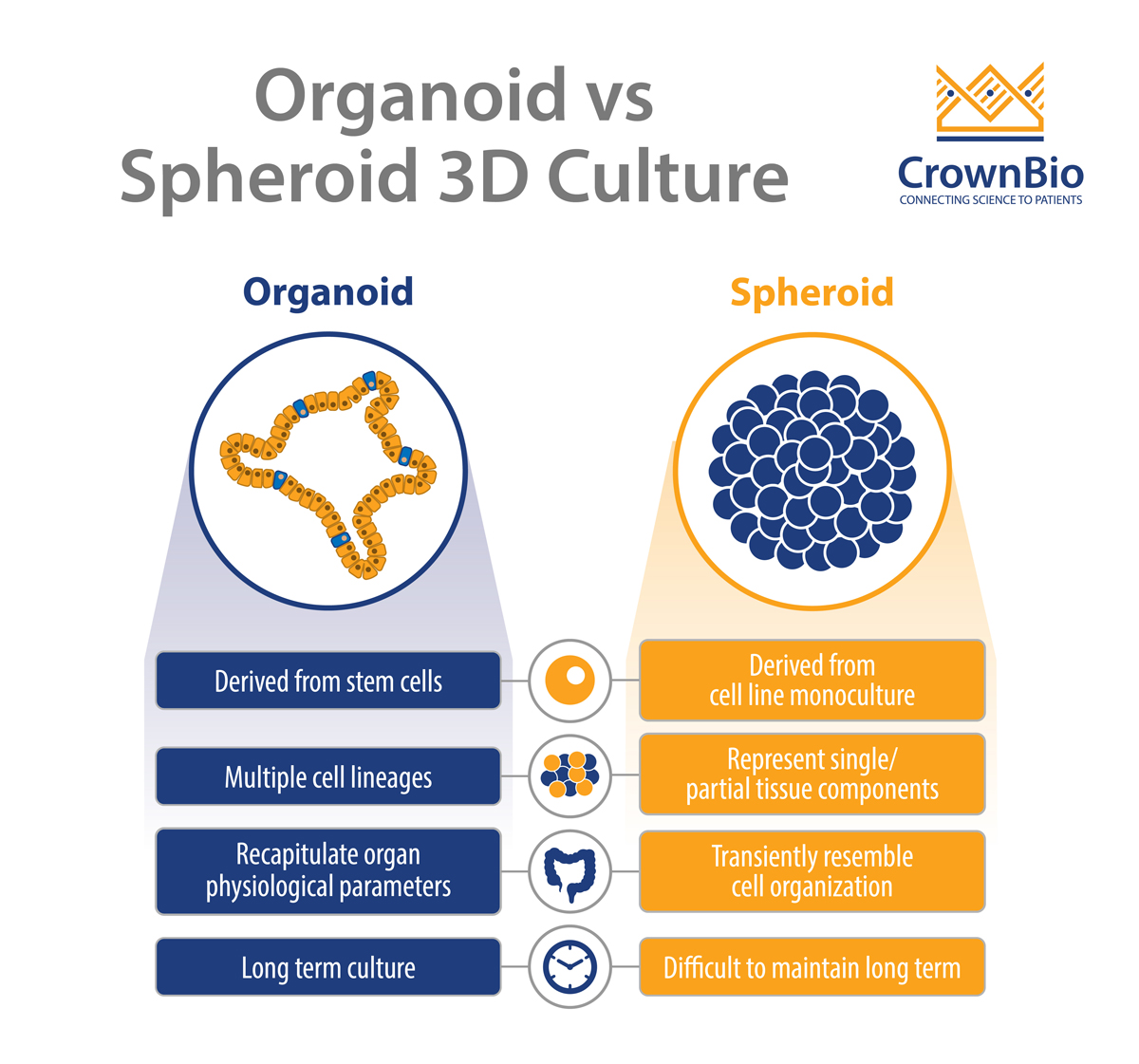
使用的两个最突出的3D细胞结构是类器官(最常在基于支架的系统上生长)和球状体(在无支架系统上生长)。
类器官3D培养
类器官是人体发育和疾病的体外模型。人们通常认为它们是器官的微型版本,并且它们通常显示出非常精确的微观解剖结构。目前已经为许多器官类型建立了类器官,包括(但不限于)小肠和大肠、肺、脑、肝、胃、肾和视网膜。
类器官通常来源于单个成体干细胞(aSC)或胚胎干细胞(ESC)。它们也可由诱导性多能干细胞(iPSC)生成,例如皮肤或血细胞,它们已被重新编程为类似胚胎的多能状态。
为了成功建立类器官,必须仔细考虑不同的可用方案,这些方案因所用干细胞的性质而有所差异。例如,尽管基于iPSC和ESC的类器官利用内源性发育过程,但必须强迫aSC形成类器官。Clevers实验室已通过补充器官特定的生长因子混合物来控制培养环境,从而针对许多器官类型成功实现了这一目标。这些生长因子模拟生理组织自我更新或损伤修复过程中的干细胞巢环境。
不管用于类器官建立的干细胞类型如何,通用环节是使用能够在体外自我更新和分化为多种谱系的干细胞。这产生了由不同细胞谱系组成的多细胞3D结构,反映了器官的重要结构和功能特性。
球状体3D培养
球状体是3D培养物,由单一细胞类型或多细胞混合物产生的细胞聚合物组成。由永生化细胞系、原代细胞或人体组织的片段建立球状体。低粘附性培养条件用于促进细胞自聚集,形成球形3D结构。
使用不同来源细胞的多细胞混合物形成球状体时,结果是“器官型培养”,表明体内组织的多细胞方面的繁殖。
通常,球状体包含细胞层,其中一些暴露在表面上,而另一些则埋在球体内。球状体是异质的,通常包括增殖性、非增殖性和坏死细胞,这些细胞可以经过良好充氧或缺氧。
类器官和球状体之间的差异
通常,有两个主要差异:
- 发育动力的性质:内部发育过程推动类器官的形成,而球状体则主要通过细胞间粘附来发育。
- 3D培养可以维持的时长:培养中细胞的长期体外扩增需要不成熟的干细胞种群来补充濒临消亡的细胞。类器官来自体外培养过程中的干细胞群并维持此干细胞群,能保证其长期生存能力。这是通过优化培养物生长条件来实现的,例如提供基底膜基质(即Matrigel®)并添加一系列激动剂(例如Wnt和酪氨酸激酶受体)和抑制剂(例如骨形态发生蛋白/转化生长因子-β)。
重要的是,类器官传代时,它们会在数代内保留原器官的遗传学特征。因此,当来源于多种组织类型时,它们可用作离体维持的“生物样本活库”。
相比之下,组织来源的球状体的长期培养具有挑战性,这可能是由于提取和维持活细胞的固有技术困难导致。
可以从各种健康以及患病的细胞类型和组织(例如患者肿瘤)中产生类器官和球状体。肿瘤来源的类器官和球状体已生成,并已广泛研究用于药物研发中。但是,由患者来源的肿瘤建立类器官和球状体存在一些关键差异。
患者来源的肿瘤类器官和球状体
患者来源的肿瘤类器官和球状体(通常称为肿瘤球)相对容易建立,并可以用作药物研发的可靠模型。
肿瘤类器官
患者来源的肿瘤类器官可以更真实地体现癌症组织中的复杂性,包括存在癌症干细胞(CSC)及其下游分化程度更高的子代。患者来源的肿瘤类器官的一些关键特征包括:
- 与2D单层和3D球状体培养相比,它们更真实地模拟患者原发性肿瘤,并有更具异质性的细胞群。通常,经典的2D和3D球状体培养逐渐富含最能经受连续体外培养的未成熟细胞,失去了与原发性患者肿瘤的相似性。
- 与患者来源的肿瘤发展一样,还可以生成健康组织的对应物。这导致可以并排比较同一患者的肿瘤与健康类器官之间的药物反应。除其他用途外,这有助于预测个体化治疗时间窗。
- 与病人异种移植(PDX)肿瘤模型相比,患者来源的肿瘤类器官的开发更具成本效益,因为它们所需的时间和资源更少。此外,类器官更适合高通量药物筛选。
- 目前已经证明它们可以在临床中有效预测患者的药物反应。
患者来源的肿瘤类器官的一个局限性在于它们可能缺乏复杂的体内系统中存在的器官间通讯。这会影响肿瘤的生长和治疗反应。特别重要的是补充到肿瘤微环境的免疫细胞,尤其是免疫治疗学的最新进展。目前正在进行研究工作以优化类器官和免疫细胞的共培养方案。
肿瘤球
肿瘤球是独立于锚定的(漂浮)球,经常用于评估体外CSC相关特征。肿瘤球的关键特性包括:
- 它们包含大量具有高复制潜力的低分化细胞。此特性让人想起体内CSC的特征,使肿瘤球成为CSC扩增的良好模型。
- 它们是无性系的,易于维持,并且易于遗传操作。这使它们非常适合高通量药物筛选(例如,筛选专门靶向CSC的药物)。
- 与2D单层培养相比,肿瘤球能更准确地反映临床耐药特性,但是,它们的 反应特性会随着传代的发展而演变,因此失去了可预测性。
当特异性寻找模拟异体原发肿瘤时,肿瘤球培养物中高比例的CSC也可以被认为是一种限制。肿瘤球的组织学特征通常与其起源的原发癌几乎没有相似之处。
结论
3D细胞培养系统可以更好地体现体内细胞微环境,这在确定细胞对外源因子(例如药物)的反应中发挥着重要作用。类器官和球状体是两个最突出的3D细胞结构,了解两个系统之间的关键差异为选择正确的方法提供了最佳机会。
球状体是更传统的3D系统,与2D培养物相比能更好地体现体内特征,并提供了一个简单易用的平台来评估CSC特性和靶向药物。
如果您需要使用3D系统获得更多原器官生理学相关性,则类器官更适用。来源于多种干细胞类型的类器官适用于健康和疾病组织的长期体外培养,提供干细胞和分化子代的异质培养。可以扩增类器官以获得组织的生物样本活库,并且疾病特异性类器官(例如源自患者肿瘤)有许多药物研发应用,包括预测患者反应。