本文探讨了抗体药物偶联物(ADC)的快速发展,包括迄今为止已获批的偶联物,以及可能会影响ADC近期和未来的创新方向。
ADC:概念与挑战
ADC是发展快速的一种抗癌剂。尽管Pfizer公司生产的Mylotarg是首批在2000年获得FDA批准的ADC,但鉴于其安全问题,于2010年下市。虽然发展初期遭遇挫折,但Mylotarg再次获得市场认可,目前市场上已有十种获FDA批准的ADC。
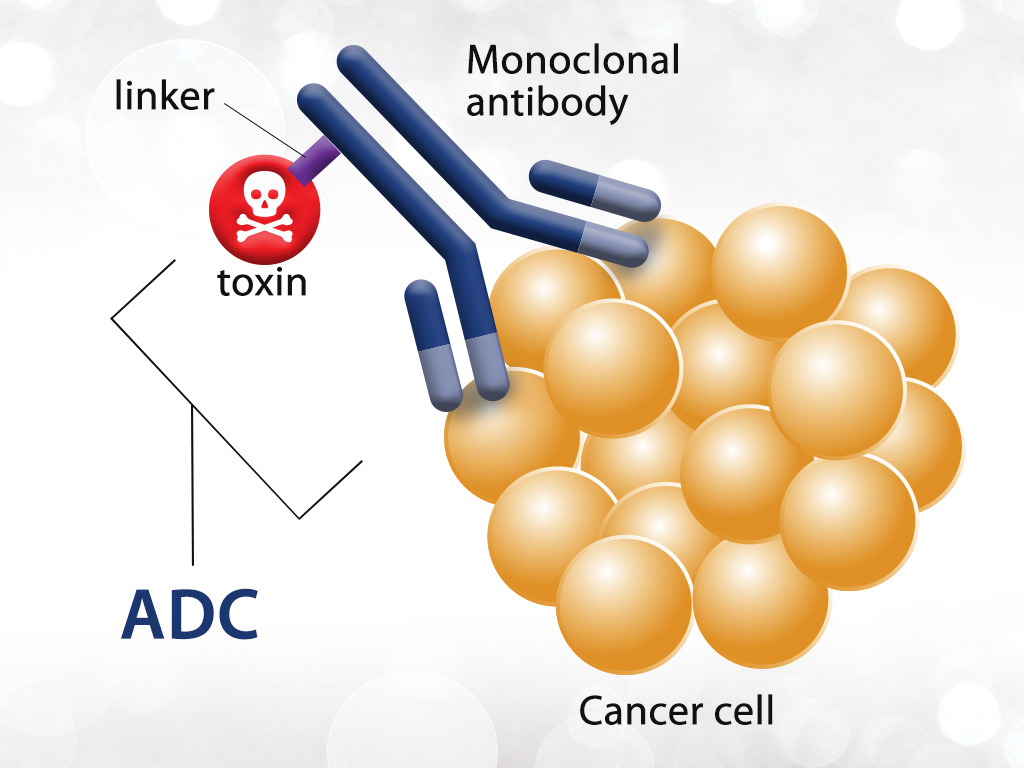
ADC是一种独特的混合药物,主要组成部分有三种:单克隆抗体(mAb)、毒性小分子以及可将二者连接的连接分子。通过研究mAb高特异性结合特征,可靶向选择高活性毒性小分子并传递至肿瘤。本方法与非靶向且非特异性的传统化疗方法形成对比。ADC的靶向方法可提高治疗癌症的细胞杀伤剂的治疗指数,并通过减少脱靶治疗的副作用提高安全性。
ADC的三个组成部分和细胞表面靶抗原的生物特性是研发最有效抗癌剂时的两个重要因素。已获批的经典内化ADC用于向靶向抗原阳性癌细胞传递高活性毒性小分子。大部分ADC使用裂解连接子,环境变化时溶酶体内化导致连接子释放毒性小分子(例如出现特异性蛋白酶和pH值变化时)。虽然释出药物可以杀死抗原阳性肿瘤细胞,但也会从靶细胞中扩散出来,杀死抗原阴性肿瘤细胞(旁观者效应)。相比之下,不可裂解连接子ADC更可能仅杀死靶向抗原阳性肿瘤细胞;非连接子的mAb会发生降解,并且由于释出药物中含有极性氨基酸(来自于连接子-小分子化合物耦合的抗体),严重损害其穿过细胞膜的能力。
作为一种新型抗癌剂,ADC面临的一些挑战正阻碍其进一步广泛发展和应用。对于最佳贮存、患者药物转运、效度和安全性均十分重要的药物稳定性就是挑战之一。稳定性十分重要,尤其当脱靶位点过早释放了药物有效荷载,就会引起脱靶毒副作用。生产过程中可能出现物理不稳定性(例如,耦合过程或温度和光线暴露),导致聚集体形成和药物活性降低。即便在肿瘤中ADC有效荷载下降的理想情况下,已知细胞毒性剂会接受一些基线水平的全身吸收。如果分解无效,毒素则会聚积在血液中,引起与全身化疗相关的典型副作用。
ADC的另一项挑战是需要一种方法,以辨识出最可能获益的特定患者。众所周知,尽管患者选择将靶抗原表达作为重要的生物标志物标准,但ADC在低水平靶抗原患者人群中也很有疗效。因此,需要更好地了解实现治疗效果所需的最低靶抗原表达水平。瘤内异质性对抗原表达的影响,以及随着治疗水平和疾病发展所出现的表达动态改变同样需要重视。
最后,耐药性仍然是所有抗癌治疗方法(包括ADC)中的主要障碍。鉴于其高分子复杂性以及可能同时涉及mAb和毒性小分子化合物,因此了解先天性耐药和获得性耐药的机制并非易事。据报道,在抗ADC的癌细胞中,靶抗原下调和/或多药外排转运蛋白表达增加。
即便挑战重重,药物开发人员正努力克服这些常见问题(这类药物最近多次获得FDA批准和大量投资可证明)(参见下一节)。克服这些挑战的关键之一在于提出全面的临床前策略,以制定新型ADC的作用机制、疗效、毒性和生物标志物策略。开发早期与资深临床前合作伙伴合作,可最大程度地促进ADC在临床上取得成功。
市售ADC
FDA已批准了十种ADC用于临床治疗。这些药物靶向多种抗原和细胞通路,并传递不同的细胞毒性小分子化合物。Lumoxiti®是一种重组无连接子ADC(又称“免疫毒素”,通过融合抗体片段和截短型毒素生成),已获批。
| ADC名称和批准日期 | 靶通路 | 小分子化合物 | 批准适应症 |
|---|---|---|---|
| Belantamab mafodotin-blmf (Blenrep®, 2020年获批) | B淋巴细胞成熟抗原 | Auristatin (微管抑制剂) | 复发或难治性多发性骨髓瘤 |
| Sacituzumab govitecan-hziy (Trodelvy™, 2020年获批) | TROP-2 | SN-38 (拓扑异构酶抑制剂) | 三阴性乳腺癌 |
| Trastuzumab deruxtecan (Enhertu®, 2019年获批) | HER2 | Deruxtecan (拓扑异构酶抑制剂) | HER2阳性乳腺癌和胃癌 |
| Enfortumab vedotin (Padcev™, 2019年获批) |
Nectin-4 | Auristatin (微管抑制剂) | 膀胱癌晚期 |
| Polatuzumab vedotin (Polivy™, 2019年获批) |
CD79b | Auristatin (微管抑制剂) | 淋巴瘤 |
| Moxetumomab pasudotox-tdfk (Lumoxiti®, 2018年获批) | CD22 | 假单胞菌外毒素A(PE) | 白血病 |
| Inotuzumab ozogamicin (Besponsa®, 2017年获批) | CD22 | 卡奇霉素(DNA裂解) | 白血病 |
| Gemtuzumab ozogamicin (MyloTarg®, 2000/2017年获批) | CD33 | 卡奇霉素(DNA裂解) | 白血病 |
| Trastuzumab emtansine (Kadcyla®, 2013年获批) | HER2 | Maytansine(微管抑制剂) | HER2-阳性乳腺癌 |
| Brentuximab vedotin (Adcetris®, 2011年获批) |
CD30 | Auristatin(微管抑制剂) | 淋巴瘤 |
ADC当前前景
血液瘤和实性瘤领域ADC研究和开发正以惊人的速度发展,主要针对晚期疾病(通常为二线或二线以上治疗)患者。2020 ASCO虚拟会议提出了一些最新重大更新。
基于“ADC复兴”,分析人士预测,2026年ADC市值将达130亿美元以上。这一观点也基于与ADC相关的一系列交易,其中包括,Merck以16亿美元的价格收购了Seattle Genetics的ADC ladiratuzumab vedotin, 和VelosBio(Merck获得了其anti-ROR ADC的使用权);Gilead以210亿美元的价格收购了Immunomedics(包括首创新药anti-TROP-2 ADC);以及Boehringer Ingelheim以12亿美元收购了NBE Therapeutics。
全球约297种ADC正在研发中,其中以“微管蛋白抑制剂”为主。一项研究估计约80种ADC正进行临床试验研究,其中至少有六种处于III期研究阶段。
结论
ADC已不是新兴概念,对此类药物的再次关注和投资正获得回报—在过去两年10种获批ADC中,有5种已获美国食品药品监督管理局(FDA)批准;
预计在2021年至少会有一种或多种ADC获批。鉴于初期发展受挫,我们努力研发改进生物偶联方法、先进抗体工程技术以及具有高稳定性和高安全性的细胞毒性药。对细胞和肿瘤生物学的日益了解也改善了靶抗原的选择。这些创新共同促成ADC的“复兴”,这为治疗癌症患者开辟了新途径。