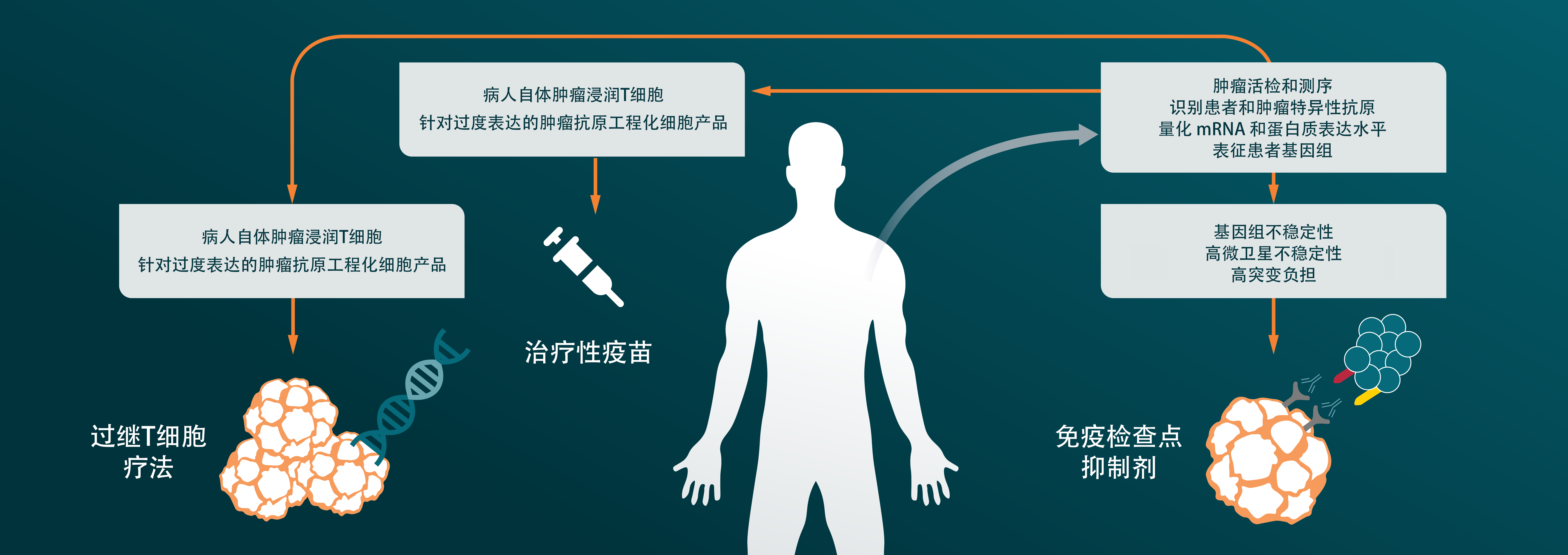
精准医疗和免疫疗法继续高居榜首,是癌症研究中最热门的两个领域。在本文中,我们将探讨免疫肿瘤学如何从精准医疗中吸取经验,设计更为个性化的癌症疗法,以增强其安全性和有效性。继续阅读,回顾ICI、新抗原疫苗和过继性细胞疗法,包括CAR-T、CAR-NK、CAR-M、TCT-T和TIL疗法,是如何推动这一非凡的科学和医疗领域发展。
为什么要采用个性化精准免疫疗法?
精准医疗是指根据每个患者的个性化特征量身定制医学治疗。这种疗法的定制涉及根据遗传、环境和生活方式因素来确定最有效的方法。
免疫疗法旨在刺激(或恢复)患者自身的免疫系统来对抗癌症。通过抗PD-1、PD-L1和CTLA-4抑制剂进行免疫检查点阻断,证明免疫系统在对抗癌症中至关重要,同时证明免疫疗法是一个新的关键治疗类别。目前,免疫检查点抑制剂(ICI)被成功地用于治疗不同阶段的各种实体瘤和恶性血液病。
然而,仅有一小部分患者对ICI具有良好反应,并且患者也可能出现严重的副作用。此外,众所周知,即使在同一种适应症中,个体肿瘤特征,如表型、遗传和肿瘤微环境,均有助于形成不同的患者反应。
因此,目前迫切需要改进免疫疗法,使用基于生物标志物的方法,根据特定的表型、遗传和/或肿瘤微环境特征,以适应每个患者的个体特征。
在这一点上,申办方应考虑在药物开发的早期建立一个生物标志物策略。这为选择最佳靶点和临床前模型提供了最佳机会,可提升临床前生物标志物转向临床的几率,从而创造更个性化的癌症免疫疗法,改善患者的治疗结局。早期生物标志物策略也为开发伴随诊断提供了充足的前置时间。
在下文中,我们将讨论在以下治疗类别中改进精准免疫疗法的潜在方法:
- ICI疗法
- 新抗原疫苗
- 过继性细胞疗法(ACT)
免疫检查点抑制剂(ICI)疗法
ICI是癌症治疗中最广泛使用的免疫疗法,但尽管在一些患者中取得了显著的成功,大多数患者对ICI疗法未产生反应或产生了耐药性。
目前,存在三种FDA批准的生物标志物可帮助预测ICI应答:
- 程序性细胞死亡配体-1(PD-L1);
- 微卫星不稳健性(MSI);以及
- 肿瘤突变负荷(TMB)
然而,我们发现这些生物标志物的重叠量最少,因此,它们可能会捕获ICI应答的独特促成因子。现在迫切需要新的预测性生物标志物来将合适的的患者和合适的ICI治疗进行匹配。目前正在开发几种新的基因标记标志物,包括:
- T细胞炎症基因表达谱(GEP);
- T细胞功能障碍与排斥基因标记(TIDE);
- 黑色素细胞可塑性标记(MPS);
- B细胞聚焦基因标记;以及
- ]预测性生物标志物的组合(如,TMB+GEP;MPS+TIDE)
除了改善预测性生物标志物,增加新抗原特异性T细胞应答的联合疗法是改善ICI疗法的另一种方法。
例如,放疗和/或化疗能够增加新抗原的数量。当与ICI治疗相结合时,会增加抗肿瘤的新抗原特异性T细胞的数量,从而可提高抗肿瘤免疫应答的量级和特异性。患者也可以接种自体肿瘤细胞,以增加T细胞可进行应答的新抗原的数量。
新抗原疫苗
癌症是一种突变驱动的疾病,它可以改变肿瘤的抗原状态,产生以下抗原:
- • 肿瘤相关抗原(TAA)—此类抗原产生于非突变蛋白的过度或异常表达。TAA在肿瘤细胞中的表达水平较高,但在健康细胞中的表达水平较低。
- • 肿瘤特异性抗原(TSA)—也被称为“新抗原”,此类抗原是由高度肿瘤特异性的突变引起的,它们在癌细胞中/细胞上大量表达,具有很强的免疫原性。新抗原产生于细胞分裂过程中随机获得的体细胞非同义变异。
研究表明,具有高突变负荷的肿瘤,如黑色素瘤和肺癌,更有可能表达免疫原性新抗原。这些新抗原不仅是肿瘤所独有的,而且也是个体患者所独有的。简而言之,新抗原是人体免疫系统尚未遇到的新抗原,因此,携带新抗原的细胞会被作为靶点并被摧毁。
目前正通过靶向患者个性化的免疫新抗原,为患者定制个性化的癌症免疫疗法。例如,正在开发新抗原疫苗,其目标是诱导全新的免疫应答,增强和拓宽内源性肿瘤特异性T细胞库,这些细胞可选择性地靶向并杀死带有此类抗原的癌细胞,而不影响非癌细胞。
由于新抗原特异性T细胞应答可能持续存在,这种疗法的另一个优势为:提供对疾病复发的长期保护。相较于传统的基于TAA的疫苗,新抗原疫苗具有更强的免疫原性和更高的肿瘤特异性。
目前,经济有效的测序和生物信息学技术已广泛用于支持新抗原疫苗的开发和使用,如已证明具有强大的肿瘤特异性免疫原性的研究,以及对黑色素瘤患者的初步抗肿瘤效应。下文的流程图描述了新抗原的合成过程。
抗原合成。首先,取肿瘤和正常组织样本。然后,通过比较两组样本的测序结果,确定肿瘤的突变基因。利用计算机、质谱或实验方法筛选出最易成为肿瘤新抗原的基因序列,最后将这些突变基因设计成疫苗,疫苗的形状多种多样,如肽疫苗、树突状细胞疫苗、RNA疫苗等。来自Zhang et. al. (2021)。Neoantigen: A New Breakthrough in Tumor Immunotherapy. Front. Immunol., 16 April 2021; doi:10.3389/fimmu.2021.672356. 基于知识共享署名(CC BY)许可证(http://creativecommons.org/licenses/by/4.0/)使用。
过继性细胞疗法(ACT)
CAR-T细胞疗法已被批准用于患者个性化的免疫治疗,这是一种新颖的免疫肿瘤学治疗模式。CAR-T细胞来自自体或异体(来自供体),这种T细胞专门靶向肿瘤细胞表面TAA。
FDA批准的第一种CAR-T疗法为Kymriah™(tisagenlecleucel)(批准于2017年),其靶向CD19抗原—此为CAR-T细胞疗法中最常见的靶向抗原。Kymriah被批准用于治疗25岁以下的复发性和/或难治性B细胞前体急性淋巴母细胞白血病(ALL)患者。批准是基于其总体缓解率显著,高达82.5%。下表列出了FDA批准的靶向CD19或BCMA的自体CAR-T细胞疗法。
| 通用名 | 商品名 | 靶向抗原 | 靶向疾病 | 患者人群 |
| Tisagenledeucel | Kymriah | CD19 | B细胞急性淋巴母细胞白血病(ALL) | 患有难治性或复发性B细胞ALL的儿童和青壮年 |
| B细胞非霍奇金淋巴瘤(NHL) | 患有复发性或难治性B细胞NHL的成人 | |||
| Axicabtagene ciloleucel | Yescarta | CD19 | B*细胞非霍奇金淋巴瘤(NHL) | 患有复发性或难治性B细胞NHL的成人 |
| 滤泡性淋巴瘤 | 患有复发性或难治性滤泡性淋巴瘤的成人 | |||
| Brexucabtagene autoleucel | Tecartus | CD19 | 套细胞淋巴瘤(MCL) | 患有复发性或难治性MCL的成人 |
| B细胞急性淋巴母细胞白血病(ALL) | 患有难治性或复发性B细胞ALL的成人 | |||
| Lisocabtagene maraleucel | Breyanzi | CD19 | B细胞非霍奇金淋巴瘤(NHL) | 患有复发性或难治性B细胞NHL的成人 |
| Idecabtagene videucel | Abecma | BCMA | 多发性骨髓瘤 | 患有复发性或难治性的多发性骨髓瘤的成人 |
| Ciltaabtagene autoleucel | Carvykti | BCMA | 多发性骨髓瘤 | 患有复发性或难治性的多发性骨髓瘤的成人 |
*此表格摘录自:最初由国家癌症研究所发表的“CAR-T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers”。
与CAR-T细胞疗法相关的少量公认局限性包括独有的副作用和CAR-T细胞衰竭,这可能会限制其有效性,特别是在实体肿瘤中。正在开发的新CAR-T疗法采用多种策略来提高其安全性,并对抗CAR-T细胞耗竭,包括抑制耗竭促进信号传递、抑制下游效应子和修饰CAR。
与使用自体CAR-T细胞相比,使用来自供体的“现成”同种异体CAR-T细胞具有以下几个优势:即时可用性、成本较低且细胞数量不受限制,但也有一些缺点,包括移植物抗宿主病(GvHD)和消除过快。
CAR-NK和CAR-M疗法
与T细胞不同的是,NK细胞可在没有MHC的情况下直接识别靶细胞,其可以通过CAR依赖性和CAR非依赖性途径杀死癌细胞。与CAR-T细胞相比,使用CAR-T自然杀伤(NK)细胞的另一个优势是,其可从已有的细胞系或MHC不匹配的同种异体NK细胞中生成,且其安全性更佳,包括降低细胞因子释放综合征和神经毒性的风险。
CAR-巨噬细胞(M)也在积极开发中。CAR-M细胞可利用巨噬细胞浸润至肿瘤中的能力,调节免疫系统,并调节其在TME中的分布情况。CAR-M细胞通过编辑CAR-M来靶向特异性抗原,识别肿瘤细胞并提高其吞噬能力。
此外,免疫抑制性M2巨噬细胞具有与促炎性M1巨噬细胞相同的强吞噬活性,也可诱导M2巨噬细胞向M1表型分化。CAR-M细胞用于癌症免疫疗法的持续推进可能有助于克服CAR-T/NK疗法的一些局限性,特别是在实体肿瘤中。
目前还没有FDA批准的此类药物,但全球有许多正在进行的临床试验。
TCR-T疗法
T细胞抗原受体(TCR)T细胞疗法具有与CAR相似但不同的信号机制,这些信号机制会产生不同的持久性、毒性和治疗效果。TCR-T细胞疗法对于靶向细胞表面的HLA具有特异性和敏感性,且TCR-T细胞可穿透肿瘤,而CAR-T细胞主要分布在肿瘤外围。与CAR-T细胞相比,TCR-T细胞的另一个优势为:具有更大的免疫受体酪氨酸活化基序(ITAM),其受体结构中有更多的亚基,并且对抗原的依赖性更弱。
目前还没有FDA批准的TCR-T细胞疗法,但全球多项正在进行的临床试验均在对其有效性和安全性进行研究。
TIL疗法
此类细胞疗法使用已浸润至肿瘤中并积极参与杀死肿瘤细胞的淋巴细胞。TIL疗法在治疗实体肿瘤时有几项公认的优势,包括多样的TCR克隆性、优越的肿瘤归巢能力和较低的脱靶毒性。
传统上,TIL细胞疗法使用肿瘤活检来识别新抗原,然后将新抗原插入自体树突状细胞中,与从肿瘤活检中分离出的TIL共培养。然后选择识别新抗原的TIL,进行扩增,并注入回患者体内。最新的方案(通常被称为“Young TIL”方法)已被证明具有与传统方法类似的临床结果,但其省去了选择步骤,缩短了TIL的产生时间,同时还具有其他优势。生成TIL细胞疗法的两种方法(“传统”方法和“Young”方法)如下所述。
目前还没有FDA批准的TIL细胞疗法,但全球多项正在进行的临床试验均在对其有效性和安全性进行研究。
TIL的产生过程示意图。从患者体中切除肿瘤后,将肿瘤消解为小片段或单细胞悬液,然后在培养液中用IL-2扩增。传统方法在“选定TIL”步骤中,通过对自体肿瘤细胞的识别来选择扩增的细胞;而“Young TIL”方法则省去了这个选择步骤。然后,将TIL培养物扩增至临床相关水平,并注入患者体内。来自Meng et al. (2021).Perspectives of tumor-infiltrating lymphocyte treatment in solid tumors. BMC Med 19, 140 (2021); doi.org/10.1186/s12916-021-02006-4. 基于知识共享署名(CC BY)许可证(http://creativecommons.org/licenses/by/4.0/)使用。
结论
为了使免疫肿瘤的潜力最大化,需通过识别患者特异性免疫抑制机制和靶向特异性新抗原采取个性化免疫疗法。除了上文所讨论的单一治疗药物策略之外,在临床研究的早期阶段,存在几种联合的个性化疗法,其中一些已显示出高安全性和有效性,如,CAR-T细胞与个性化溶瘤疫苗的联合使用。