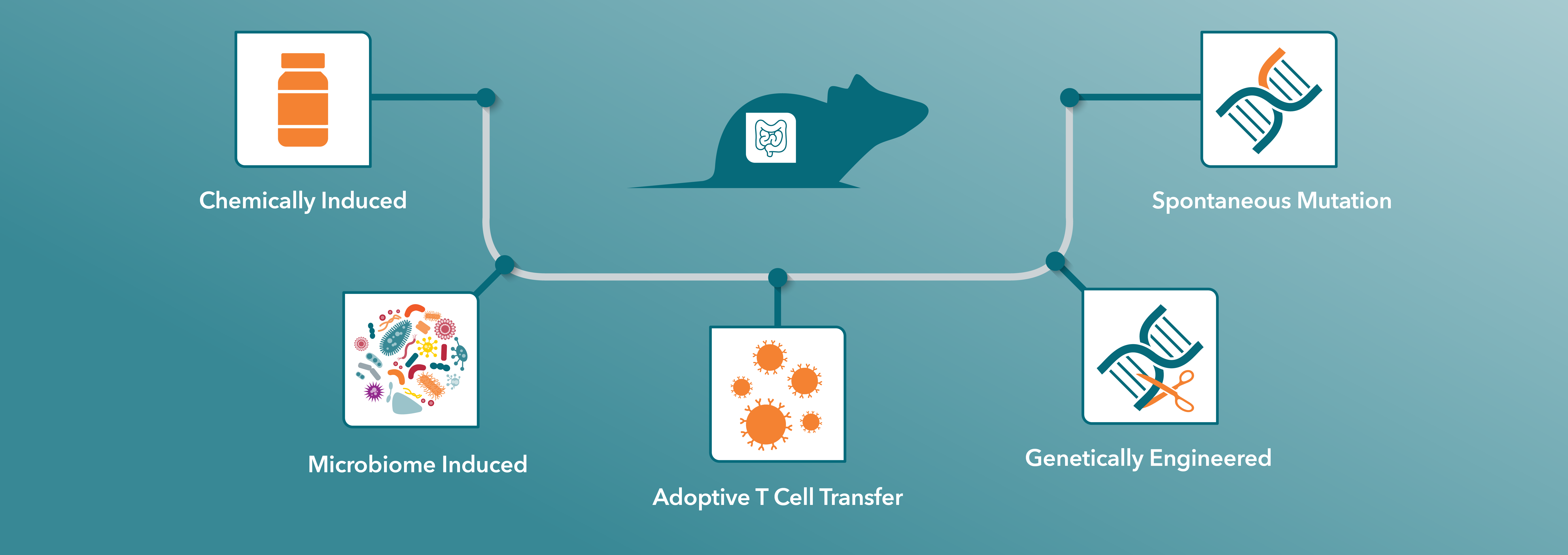
在本文中,我们探索了可供研究人员使用的各种炎症性肠病(IBD)小鼠模型,包括这些模型的独特特征。理解这些模型之间的重要差异,是针对具体研究问题选择最佳模型的关键。
选择用于IBD研究的小鼠模型
选择用于 IBD 临床前研究的小鼠模型,并不总是一件简单的事情。这是因为存在许多不同的模型类型和子类型可供您选择(参见下文中的关键模型表)。选择最合适的模型,在很大程度上,受到靶点和药物的生物学和病理学特征以及测试药物所需疾病分期的影响。不同的模型兼具有不同的优点和缺点,因此,应提前进行优缺点权衡。

来源:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4435576/pdf/main.pdf
常用IBD小鼠模型
| 模型示例 | 应答部位 | 普遍应答类型 | 免疫病理学 | |
|---|---|---|---|---|
| 化学诱导 | DSS | 结肠 | 上皮损伤 | Th1 为急性 DSS,Th1/2 为慢性 DSS。 NLRP6缺陷小鼠(NLRP6 是一种仅在上皮细胞中产生的炎性体蛋白,会导致更严重的 DSS 结肠炎) |
| TNBS | 结肠 | 免疫介导的上皮损伤 | TH1介导,以CD4+ T 细胞、中性粒细胞和巨噬细胞固有层浸润为特征。TNFSF15 阻断可完全阻断小鼠 TNBS 结肠炎。 | |
| 恶唑酮 | 结肠 | 免疫介导的上皮损伤 | IL-13和NKT 介导 在 SJL/J 或 C57BL/10 小鼠和 C57BL/6 小鼠中,均更易于诱导出对这种结肠炎的抵抗力还能够在 BALB/c 中诱导出慢性结肠炎 | |
| 自发性突变 | SAMP1/Yit | 回肠 | 免疫介导 | 由 TH1 驱动的回肠末端和盲肠严重炎症 |
| C3H/HeJBir (C3Bir) | 结肠 | 免疫介导 | Th1 | |
| 过继性T细胞转移 | CD4+CD45RBhi | 结肠 | 免疫介导 | Th1 和/或 Th17 |
| 基因改造 | IL-10-/- | 结肠 | 免疫介导 | 已建立的 Th1 |
| 微生物组诱导 | 无菌 IL-10-/- +/- 微生物转移 | 结肠 | 免疫介导 | Th1 / Th17 |
不同的模型在组织学、治疗反应、疾病部位等方面(在不同程度上)具有不同的 IBD 特性。本文回顾了主要模型类型,探讨了这些模型的独特特征和潜在用途。
化学诱导 IBD 小鼠模型
使用最为广泛的模型是具有化学诱导疾病的模型(例如,葡聚糖硫酸钠 [DSS]、三硝基苯磺酸 [TNBS] 或恶唑酮诱导的模型)。这些模型的主要优点在于相对便宜,开发快速且简单。由于疾病诱导方法不同,这一类别中的不同模型具有各自的特定用途。
DDS 诱导结肠炎模型
DSS 是一种带负电荷的硫酸多糖。它会损害小鼠的上皮细胞。随后,先天免疫细胞会释放细胞因子,引起结肠炎症,其特征为溃疡和粒细胞浸润。
DSS 诱导结肠炎模型的常见用途包括损伤期间或之后维持或重建上皮完整性的研究因素,以及肠道炎症中累及先天免疫系统的方式。
这些模型对环孢素A也存在应答,为评估以相同免疫机制为靶点的新药物(例如,新免疫抑制剂)提供了相关模型。
TNBS 诱导结肠炎模型
TNBS 是一种半抗原化剂。它是一种小分子,虽然本身并不具有抗原性,但是与宿主蛋白结合时会引起免疫应答。使用 TNBS 可制成复制临床克罗恩病(CD)的临床前小鼠模型。免疫应答由 Th1 介导,其特征为 CD4+ T 细胞、中性粒细胞和巨噬细胞浸润。炎症横向扩散,可引发透壁性结肠炎。
TNBS 诱导结肠炎模型是研究 CD 免疫学方面和测试潜在免疫疗法疗效的理想模型。
恶唑酮诱导结肠炎模型
恶唑酮也是一种半抗原化剂,但是它诱导的炎症类型与 TNBS 不同。这一模型更像是临床溃疡性结肠炎模型,在免疫发病机制上有一些相似性。免疫应答由 Th2 介导,可引发弥漫性结肠炎症。
这一模型往往用于研究皮肤延迟型超敏反应。它还用于评估为以 Th2 介导机制为靶点的药物。
化学诱导模型限制
任何化学诱导 IBD 模型均需要考虑几个变量。应始终使用相同的方案。为了确保研究的可重复性,您应该密切监测化学品批次、品系、性别、动物来源、化学品供应商、剂量水平、频率和持续时间。这种类型的模型也可能是严重疾病模型,其中,TNBS 模型比 DSS 模型的严重程度更高。
自发性突变 IBD 小鼠模型
这组模型的 IBD 是由自发发生的突变发展得出,而不是由基因过度表达或基因抑制得出。常用模型包括 SAMP1/Yit 和 C3H/HeJBir(C3Bir),均代表慢性肠炎症模型。
Samp1/YitFc 结肠炎
临床 CD 模型采用 SAMP1/Yit 亚系小鼠并根据疾病部位、组织学特性和治疗反应建立。回肠末端(临床 CD 病变的主要部位)可见自发性炎症,其中大量活化 CD4+ 和 CD8α+TCRαβ+ T 细胞浸润至固有层。
在该亚系中,IBD 的发展和疾病进展遵循一个明确的时间过程,为评估不同疾病分期的新疗法提供了一种良好的模型。该亚系对抗TNF治疗的反应与临床患者相似,在评估类似新药方面显示出有效性和可转译性。
C3H/HeJBir(C3Bir)结肠炎
C3H/HeJBir亚系小鼠发生的疾病主要为右侧结肠炎,其特征为急性和慢性炎症。该亚系为IBD免疫发病机制的研究提供了一种宝贵的模型,显示肠道菌群中B和T细胞对抗原反应性的增加,以及针对特定细菌抗原的血清 IgG 抗体水平较高。
自发性突变模型限制
该模型的一个主要限制是疾病完全外显所需的时间。例如,对于 SAMP1/Yit 亚系,100% 外显率大约需要30周。这可能会导致研究时间表耗时较长且花费高昂。
过继性T细胞转移IBD小鼠模型
过继性T细胞转移模型诱导出慢性小肠和结肠炎症,这在一些关键方面与人类 IBD 相似。CD4+CD45RBhi T细胞(CD25-)从供体 BALB/c 脾细胞中分离。细胞转移至同源免疫缺陷 SCID 或 RAG2-/- 受体,产生结肠原发性炎症模型。
这种炎症可归因于初始T细胞系中缺乏 Treg 细胞。因此,采用过继性T细胞转移模型来研究致病性T细胞在黏膜炎症中的作用。大量的 Treg 和其他T细胞系研究均依赖于这种模型。
过继性T细胞转移模型限制
由于该模型使用的是免疫缺陷小鼠,因此无法对结肠炎的发展进行全面概述。
基因改造 IBD 小鼠模型
基因改造 IBD 小鼠模型自发发生结肠炎和/或回肠炎。许多模型均含有人类IBD中发现的易感基因。最著名的模型是组成性敲除 IL-10-/- 小鼠,在其开发25年后仍在研究中使用。
IL-10-/- 敲除小鼠
IL-10 KO 小鼠自发发生结肠炎,因为其 Treg 细胞无法产生 IL-10。特别是可见结肠炎症,其特征为淋巴细胞、巨噬细胞和中性粒细胞炎性浸润。疾病严重程度可通过所使用的背景品系进行调节。与 C57BL/6 小鼠相比,BALB/c 小鼠中观察到的疾病更为严重。
结肠炎发展超过24周,制成可用于研究不同 IBD 免疫机制的模型。还能够对 Tregs 进行研究,因为它们确实保留了一些功能(带有IL-10被移除的明显警告)。
IL-10-/- 敲除小鼠限制
该模型的一个限制是,由于该模型高度依赖于微生物组差异,因此在不同的试验机构中结肠炎发生可能存在较大差异。它的疾病发展时间也较长。可通过吡罗昔康加速和同步结肠炎发病,但是这需要仔细验证剂量、处方、小鼠年龄和微生物状态。
在这一模型中未见体重下降。您可以对其他临床指标进行监测,但是其中一些临床指标只有在疾病程度严重时才会出现。一种用于监测炎症水平的更有效、更灵敏的经验证方法是测量粪便中的脂质运载蛋白2。
微生物组诱导 IBD 小鼠模型
在 IBD 模型中,免疫介导的肠道炎症与肠道细菌有关。例如,在 IL-10 敲除小鼠(和其他 IBD 模型)中,微生物组对黏膜免疫系统的刺激对结肠炎的发展至关重要。
微生物组在人类 IBD 中的确切致病作用尚不清楚,部分原因是微生物组是在 IBD 发生后分析的。但是,肠道共生菌和菌群失调在 IBD 发病机制中的重要性已得到广泛研究。
有证据表明,抗生素可改善和减轻 IBD 患者体内的黏膜炎症。此外,近期已在小鼠中对一种全新的粪便菌群移植(FMT)策略进行临床前和临床研究。FMT 旨在通过调节肠道菌群紊乱和恢复宿主与肠道微生物之间的内稳态来逆转疾病。
将选定的细菌(例如,肝型螺旋桿菌,单独或与其他细菌一起)或微生物群混合物引入无菌 IL-10-/-动物,可在 2-4 周内加速结肠炎的发展。因此,微生物组诱导小鼠模型提供了一种可用于评估抗菌治疗和研究有益或致病微生物或微生物群落的工具。
微生物组诱导小鼠限制
这些限制包括可变定殖,以及诱导前所需的无菌条件难以控制。无菌小鼠也可能存在食物消化问题,因此在模型诱导时需要考虑到这一点。
新兴途径和模型
有报告称,IBD 在T细胞功能障碍/衰竭(特别是 CD39+ CD8+ T 细胞)中起保护作用。因此,与T细胞衰竭相关的共同抑制标记物可能既是疾病状态标记物,也是治疗候选物。在临床中,基于 CD39– 的基因签名与无复发存活率相关。
在该领域中,另一项最新进展是对β-己糖胺酶(β-hex)的鉴定,这是一种高度保守的酶,由拟杆菌门的共生体产生。这种抗原驱动了肠道中 CD4+CD8αα+ 上皮内淋巴细胞(CD4IEL)的分化。CD4IEL和调节性T细胞均可识别 β-hex 肽。当转移至小鼠体内时,β-hex 特异性 CD4 T 细胞进入定位于小肠的 CD4IEL,并以与调节性T细胞无关的方式抑制炎症反应。
结论
IBD 小鼠模型是用于临床前研究和药物开发的宝贵工具。虽然没有一种模型是完全临床相关的,但是可使用不同的模型来研究不同和具体的疾病机制。研究人员可通过了解可用模型范围内的差异、优点和缺点,选择出最合适每项研究的一种模型。