免费参与我们新推出的癌症免疫周期(CIC)系列网络研讨会“ 癌症-免疫周期:方法、挑战和机会”。该系列网络研讨会共有四次讲座,内容如下:
- 利用先进体外技术探究癌症免疫周期对癌症治疗的影响
- 癌症免疫周期内靶向T细胞
- 通过体外试验分析免疫抑制性肿瘤微环境
- 癌症免疫疗法临床前研究的后续方向是什么?
本文介绍了该系列网络研讨会的重点内容,探讨了 CIC 及其重要意义,以及如何利用CIC促进癌症免疫治疗新药的研究开发。
什么是癌症免疫周期(CIC),它有何重要意义?
要充分发掘肿瘤免疫治疗新药和新疗法的潜力,就必须全面了解肿瘤细胞、人体免疫系统及癌症免疫治疗新药和新疗法之间的相互作用。为此,我们必须先了解一下 CIC。
2013年Chen and Mellman 在研究报告中指出,CIC包括免疫介导消除癌细胞所需的一系列生物学过程步骤。CIC的过程步骤如下:
第一步,即将凋亡的肿瘤细胞释放出肿瘤特异性抗原(肿瘤新生抗原)。随后激发抗原呈递细胞(如树突状细胞 [DC]),然后呈递给淋巴结中的初始T细胞。T细胞被激活后,迁移或被转运至肿瘤部位,浸润并将肿瘤细胞识别为外源物质;最后一步是T细胞介导肿瘤细胞杀伤、进一步释放抗原和启动下一个周期。CIC 的各个步骤如图1所示。
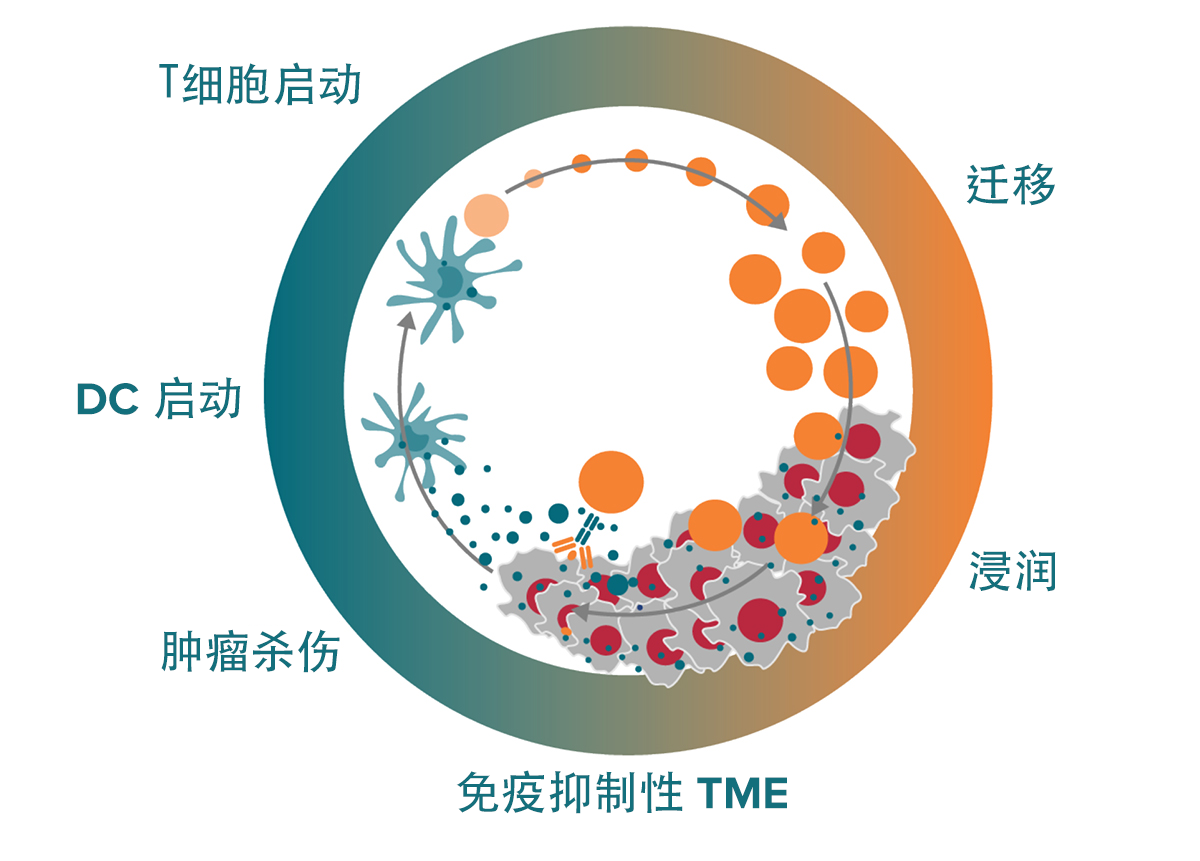
图1: 癌症免疫周期
如何调节CIC?
在理想情况下,CIC 能够有效发挥作用,从而消除肿瘤细胞。CIC 具备多重故障安全机制,使该周期受到严格控制,以免对正常组织造成自身免疫性损伤。CIC 过程中有多种不同的刺激和抑制因子发挥作用,以确保精准高效地消除肿瘤细胞,包括检查点蛋白(如 PD-1 和 CTLA4)。这些因子对控制T细胞应答至关重要。
此外还有一些其他重要的 CIC 调节因子,包括调节树突状细胞启动的促炎性细胞因子(如 TNF-α 和 IL-1)、影响T细胞活化的共刺激因子(例如 CD27 和 OX40),以及控制T细胞迁移至肿瘤部位的各种趋化因子。
但对于癌症患者而言,CIC 在任何步骤都可能受损,例如由于缺乏即将凋亡的肿瘤细胞或功能失调的免疫检查点而导致无法有效释放抗原,进而导致抗肿瘤免疫差和疾病进展。
免疫疗法开发的一个主要目标是克服阻断并重新激活 CIC,以促进识别和消肿瘤细胞除。
免疫疗法可以靶向哪些 CIC 步骤?
检查点蛋白(如 CTLA4 和 PD-1/PD-L1)是T细胞抗肿瘤免疫应答的关键负向调节因子。使用抑制剂阻断检查点蛋白可以松开其对T细胞活性的“刹车机制”,释放出T细胞对肿瘤细胞的强烈免疫应答。除了检查点抑制剂之外,其他靶向药物、溶瘤病毒和传统疗法(即放疗和化疗)可以通过杀伤肿瘤细胞和促进抗原释放来重新激活 CIC。此外,诸如工程细胞疗法(例如,CAR-T)和双/三特异性T细胞衔接器等疗法可以调节和增强 CI C中的T细胞活化和迁移、肿瘤细胞浸润和根除步骤。此外,认为靶向抑制性细胞(如骨髓抑制因子)和肿瘤微环境(TME)中的其他因子对免疫治疗的成功与否起到关键作用。
考虑到 CIC 的复杂性,研究人员需要结合使用临床前模型和工具来剖析 CIC 的每个步骤,这样不仅能解决与抗肿瘤免疫相关的具体问题,还能确定有前景的免疫治疗新靶点。
如何确定选用 2D、3D、体内或离体模型?
在研发新免疫疗法过程中,可以选用一系列临床前体外和体内模型。但是,针对不同研究选择合适的模型是有难度的,因为每种模型都各有有约缺点,应结合考虑。
传统癌症研究依赖于 2D 系统,但现在越来越多的研究人员和药物开发商采用 3D 细胞培养,因为它们能更准确地重现细胞间的相互作用,而这种相互作用会影响细胞信号传导、增殖、生存能力和药物反应。采用HUB 方案通过对正常或疾病组织的成体干细胞进行培养而获得的类器官是与患者高度相关的培养物,即使经过长期培养和冷冻保存后仍能准确地重现患者原始肿瘤细胞的表型、形态和基因特征。类器官的应用优势在越来越多的肿瘤类型中得到了验证。它们的独特之处在于具有可扩展性(例如用于高通量筛选),而且可用于生物样本库和药物筛选的开发。
可以通过免疫共培养试验进一步增强3D培养的价值。这些系统可以相对简单,添加单一细胞类型(例如反应性 T 细胞),也可以通过整合多种细胞类型(例如免疫细胞和成纤维细胞)的设置来重建 TME 的关键组件,从而实现更先进的系统。冠科生物的 3D 离体患者组织平台(EVPT)将新鲜样本直接放入培养物中,无需消化或预培养步骤,从而保留了组织样本中的内源性细胞群,实现了更天然的肿瘤微环境(TME)。EVPT 模型包含了TME中发现的完整细胞类型(即免疫细胞、基质细胞和成纤维细胞),因此是研究 CIC 和药物作用的理想模型。
总体而言,3D 培养具有更高的转化价值,在体外药物发现的应用中通常优于标准的 2D 培养。低复杂性的3D培养系统可以用于先导候选药物的筛选,而 更具创新性的共培养系统可用于超越细胞活力以外的分析,例如对TME的影响和 CIC 中其他复杂的步骤。这些体外实验结果可以为使用临床前动物模型开展深入研究提供参考数据。在开始一项新研究之前,建议先咨询在针对不同研究课题选择合适模型方面具有丰富知识的专家。冠科生物的在线数据库中整理了各种临床前模型的特征及相关信息,可以帮助研究人员识别筛选类器官模型、细胞系和体内模型。
高内涵成像(HCI)和高内涵分析(HCA)的兴起
HCI 和 HCA 使用先进的显微镜和强大的算法进行药物发现和验证研究,特别是当与临床高度相关的3D体外类器官结合时。结合这些技术,可以让您开发出展示化合物影响细胞系统和空间生物学包括癌细胞和免疫细胞在3D中的动态相互作用的全面细胞谱。
由于 HCI 提供了个体的详细读数,因此暴露于T细胞衔接器、工程T细胞或检查点抑制剂后类器官体积和大小的变化以及免疫细胞增殖均可定量,并可提供肿瘤细胞杀伤检测。当与适当的细胞示踪染料一起使用时,也可以用于评估其他参数,如免疫细胞迁移和肿瘤浸润。
HCI 在验证一种新型体外T细胞耗竭平台方面也发挥了重要作用。当抗原未被清除时(CIC 的步骤3),就会发生T细胞耗竭,这种微弱但慢性的激活最终导致无应答状态。由于这可能会阻碍抗肿瘤免疫,因此需要重现这一过程的检测方法来能够确定延迟或逆转耗竭的候选药物。
HCI 还可用于更复杂的共培养物分析,这些共培养物包含T细胞以外的其他细胞参与者,并模拟 TME。例如,癌症相关成纤维细胞(CAFs)在调节癌细胞行为和药物反应中发挥核心作用。通过将肿瘤类器官与成纤维细胞混合,模拟由类器官、成纤维细胞和 PBMC 构成的肿瘤,从而构建模拟间充质TME的共培养系统。这些先进的三重共培养系统受益于 HCI,可以识别不同的细胞群,并输出暴露于免疫治疗候选物后类器官表型和免疫细胞反应的准确测量值。
结论
了解癌症免疫周期对于新一代免疫疗法的研发起到重要作用。我们新推出的按需网络研讨会系列癌症免疫周期:方法、挑战和机会提供了有关CIC的重要信息,包括如何对CIC的每个步骤进行临床前研究,从而筛选出有利于临床试验成功的最佳候选药物。