回顾在体外肿瘤药物筛选程序中使用肿瘤类器官的方式和原因。
为什么使用类器官进行肿瘤药物筛选?
在我们直接进入如何使用肿瘤类器官进行药物筛选之前,需要回答的一个关键问题是为什么要使用类器官——为何不继续使用现在使用的标准体外药物筛选平台?
主要答案是临床相关性。典型的药物研发在很大程度上依赖于永生化细胞系进行高通量筛选(HTS),同时测试靶点结合和细胞活性。尽管此方法有许多优点,但持续维持在塑料上会导致细胞系遗传漂变、可译性差和疾病相关性降低。所有这些导致目前在肿瘤药物开发中观察到高磨耗率。
尽管已使用临床材料开发了更具预测性的模型,例如离体原代培养物或体内 患者异种移植(PDX)肿瘤模型,但这些模型并不适合HTS。对于后续研究,原代培养物受到可用组织数量和扩增的限制。
PDX在体内稳定培养,并为后期药物开发(包括通过小鼠临床试验(MCT))提供了高度转译平台。但是,PDX开发的时间和成本过高,并且对于高通量体外使用,这些模型尚未有效反向转译。
现在迫切需要早期稳健且可扩展的筛选平台,提供临床相关的可译数据,以尽早指导药物开发、患者选择和伴随诊断(CDx)开发。类器官有潜力填补这一空白,并提供克服当前筛选挑战所需的体外临床前模型。
肿瘤类器官
我们在以前的公告中广泛撰写了有关类器官和肿瘤类器官的背景和开发 的信息。简而言之,患者来源的类器官是在3D中生长的干细胞或祖细胞体外产生的。类器官具有自我组织和自我更新的能力,从而导致培养皿中“微型器官”的发育。这些类器官包含多个分化的细胞谱系,这些谱系与体内起源器官具有显著相似性。
Hubrecht Organoid Technology(HUB)的开拓性工作已经产生了稳健的方案,可以由正常和患病组织的成体干细胞开发类器官。HUB肿瘤类器官体现了其亲代肿瘤的基因组、形态和病理生理学特征。这为药物研发提供了高度临床相关的3D体外肿瘤模型。
将肿瘤类器官冷冻保存以生成模型生物样本库,并在复苏后扩增而不会失去类器官的原始身份特征。这意味着类器官是了解癌症分子机制以及开发新疗法的良好工具。肿瘤类器官还可以预测患者的治疗反应,因此可提供比标准2D体外平台更相关的体外模型。
使用肿瘤类器官进行药物筛选
建立最大的肿瘤类器官库来重现肿瘤的人源化
要开始使用肿瘤类器官进行肿瘤药物筛选,第一步是要开发大量类器官模型,涵盖广泛的癌症类型,类似于目前可用于小鼠临床试验的HTS或PDX保藏的大量细胞系。
历史上,肿瘤类器官直接来源于患者肿瘤(患者来源的类器官或PDO)。尽管这仍然是产生密切相关模型进行筛选的高度有效的技术,但是开发必需的大量模型可能很耗时,因为必须从多种不同的癌症中获取患者的肿瘤组织。
一种新方法是从已获得并有良好注释的大量体内PDX模型中开发PDX来源类器官(PDXO)。这提供了一个独特的机会来扩增可用的患者来源类器官模型的全部种类,包括具有一系列突变特征和药理反应的更广泛的癌症适应症。这包括反应不良或耐药的肿瘤。
PDXO是由PDX肿瘤中发现的癌症干细胞建立,就像PDO源自患者肿瘤一样。基于共同的基因组多样性、肿瘤异质性、组织病理学和对药物的反应,成熟的PDXO和亲代PDX具有生物学等效性。PDXO在多次传代过程中也保持了相应PDX肿瘤的稳定基因组、形态和病理生理特性。
因此,这突出显示了PDXO是一个独特的体外平台,其特征在于PDX模型的金标准患者相关性、传统患者来源的类器官的可扩展性以及已生成的数千个PDX保藏的开发效率。这种组合为患者相关模型中的大规模药物筛选提供了理想的平台,包括组合策略测试、生物标志物识别和CDx开发。
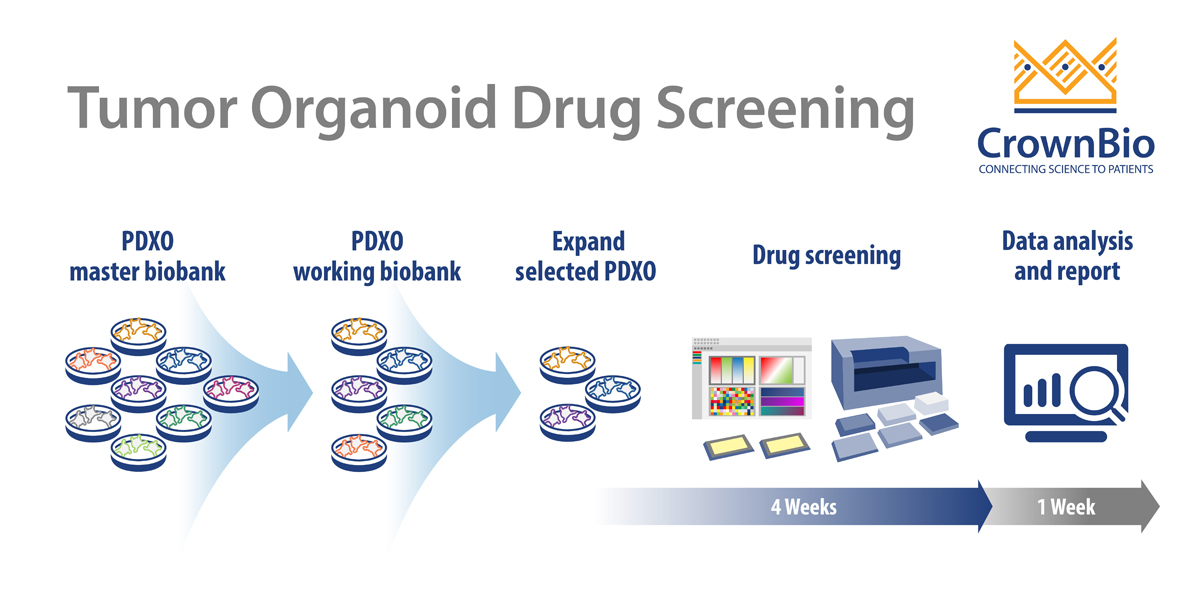
PDXO筛选工作流程
像其他典型的HTS筛选一样,PDXO药物筛选是一种自动化、高度可重现且稳健的系统,目的旨在提高效率。在早期药物开发中,PDX筛选带来的额外优势是高度可预测性。
从冷冻保存模型的主生物样本库开始,PDXO扩增为可用于HTS的工作生物样本库。这些PDXO生物样本库经过支原体测试,并通过足量的入库、复苏和生长图谱分析对STR进行了分析,从而可以重复使用模型。可以从在线类器官生物样本库数据库中选择特定的类器官。然后根据需要扩增所选的PDXO,并接种到多孔板中进行药物筛选。
筛选以类似于2D筛选的方式运行:
- 384孔格式
- 通常,用8个化合物的IC50值生成
- 每板上均有阳性和阴性对照。
将测试剂与类器官一起孵育5天,以CellTiter-Glo®活力读数或形态学评估为终点。对于多种药剂和多种肿瘤模型,模型扩增并纳入研究以进行IC50读数和分析的过程最快可能需要5周。终点读数可以扩展到其他生理学参数,例如细胞凋亡或高内涵成像。
肿瘤类药物在药物筛选中的主要优势
通常在肿瘤药物筛选中使用类器官有很多优势,其中一些如上所述。筛选包括由于保留原始和表型特征以及肿瘤3D架构而增加患者相关性的类器官,已知所有这些因素都会影响药物反应。
肿瘤类器官药物筛选还提供了高质量读数,例如,高信噪比和低板内变化,证明了平台的稳健性。
PDXO筛选可在大量肿瘤模型中对化合物及其组合进行更广泛的评估。然后可以使用匹配的PDX模型直接将研究转移到体内建模。
肿瘤类器官和标准2D药物筛选之间的差异
计划类器官筛选时,需要考虑与标准2D筛选之间的一些差异。
如上所述,肿瘤类器官可以冷冻保存,然后复苏以用于HTS入组。这可能导致导入时间略长于标准体外细胞系。
当前用于类器官筛选的384格式也没有标准细胞系HTS的通量高。这部分是由于类器官的扩增潜力导致,因为类器官的培养和接种标准不同于2D单层培养。例如,3D培养中类器官的大小、密度和形态,以及传代步骤需要更多的时间。
因此,在设计筛选方案以及肿瘤类器官的基因组、组织病理学和药理学分析时,必须要有类器官培养的经验和专业知识。
根据肿瘤类器官的临床相关性,很明显其他体外筛选工具无法匹配类器官筛选数据。在早期药物研发中,如此大规模筛选的可用性令人兴奋。
结论
缺乏能体现原发性患者肿瘤的临床前模型系统是早期肿瘤学药物开发的主要挫折。在大规模药物筛选中使用体外肿瘤类器官可以帮助克服这一问题,提供一个稳健、可扩展和可预测的3D系统,以重振当前的开发工作流程。